
第二類體外診斷試劑注冊證(首次注冊)服務
依據《體外診斷試劑注冊與備案管理辦法》第六條規定,申請境內第二類體外診斷試劑產品注冊的,由省、自治區、直轄市藥監管理部門審查,批準后發給醫療器械注冊證。二類ivd產品范圍如...
服務價:¥電議
好評系數:

依據《體外診斷試劑注冊與備案管理辦法》第六條規定,申請境內第二類體外診斷試劑產品注冊的,由省、自治區、直轄市藥監管理部門審查,批準后發給醫療器械注冊證。二類體外診斷試劑ivd產品范圍如下:
| 類別 | 產品范圍 | 分類注冊管理 |
|---|---|---|
| 第Ⅱ類產品 | 1、用于蛋白質檢測的試劑; 2、用于糖類檢測的試劑; 3、用于激素檢測的試劑; 4、用于酶類檢測的試劑; 5、用于脂類檢測的試劑; 6、用于維生素檢測的試劑; 7、用于無機離子檢測的試劑; 8、用于藥物及藥物代謝物檢測的試劑; 9、用于自身抗體檢測的試劑; 10、用于微生物鑒別或藥敏試驗的試劑; 11、用于其他生理、生化或免疫功能指標檢測的試劑; | 由省、自治區、直轄市藥品監督管理部門審查,批準后發給醫療器械注冊證書。 |
第二類體外診斷試劑首次注冊的申報條件
根據體外診斷試劑注冊管理辦法的規定,在中國境內銷售、使用的第二類體外診斷試劑,必須先通過申請注冊。對于境內首次申請注冊第二類體外診斷試劑,需要滿足下列條件:
1、申請注冊的產品已經列入國家藥品監督管理總局制定的體外診斷試劑產品分類目錄,且管理類別為第二類。如果是新研制尚未列入分類目錄的體外診斷試劑,申請人可以直接向國家藥品監督管理總局申請第三類體外診斷試劑產品注冊,也可以依據分類規則判斷產品類別并向國家藥品監督管理總局申請類別確認后,再申請產品注冊或者辦理產品備案。
2、申請人必須是所在申請轄區范圍依法進行登記的企業。
3、申請人建立與產品研制、生產有關的質量管理體系,并保持有效運行,而且申請注冊時樣品不得委托其他企業生產,按照創新醫療器械特別審批程序審批的產品除外。
4、辦理體外診斷試劑注冊事務的人員應當具有相應的專業知識,熟悉醫療器械注冊管理的法律、法規、規章和技術要求。申請人申請注冊,應當遵循體外診斷試劑安全有效的各項要求,保證研制過程規范,所有數據真實、完整和可溯源。
5、申請注冊的資料應當使用中文,如果是根據外文資料翻譯的,應當同時提供原文;如果引用未公開發表的文獻資料時,應當提供資料所有者許可使用的證明文件。
6、申請要符合體外診斷試劑注冊管理辦法的規定,申報材料經技術審評機構技術審評,而且符合安全、有效要求。
二類IVD產品首次注冊申報資料要求
1、申請表
申請人應當根據要求填寫注冊申請表。
2、證明性文件
(1)申請人營業執照副本及生產企業許可證復印件(所申請產品應當在生產企業許可證核定的生產范圍之內)。
(2)申請人有關提交資料真實性的聲明。
3、綜述資料
(1)產品的預期用途:產品的預期用途,與預期用途相關的臨床適應癥背景情況,如臨床適應癥的發生率、易感人群等,相關的臨床或實驗室診斷方法等。
(2)產品描述:包括產品所采用的技術原理,主要原材料的來源及制備方法,主要生產工藝過程,質控品、標準品(校準品)的制備方法及溯源情況。
(3)有關生物安全性方面的說明:由于體外診斷試劑中的主要原材料可能是由各種動物、病原體、人源的組織和體液等生物材料經處理或添加某些物質制備而成,為保證產品在運輸、使用過程中對使用者和環境的安全,研究者對上述原材料所采用的滅活等試驗方法的說明。
(4)有關產品主要研究結果的總結和評價。
(5)其他:包括同類產品在國內外批準上市的情況。相關產品所采用的技術方法及臨床應用情況,申請注冊產品與國內外同類產品的異同等。對于新診斷試劑產品,需提供被測物與預期適用的臨床適應癥之間關系的文獻資料。
4、產品說明書
應當符合《醫療器械說明書、標簽和包裝標識管理規定》的有關要求,并參考有關技術指導原則編寫。
說明書中的產品名稱可同時包括通用名稱、商品名稱和英文名稱。通用名稱應當符合《體外診斷試劑注冊與備案管理辦法》中有關的命名原則。
5、擬訂產品標準及編制說明
擬訂產品標準的文本及編制說明應當符合《醫療器械標準管理辦法》的相關規定。對于第三類產品,擬訂產品標準的內容應當參照《生物制品規程》(2000版)編制。
6、注冊檢測報告
由國家藥品監督管理局認可的檢測機構出具的注冊檢測報告。
7、分析性能評估資料
一般情況下,分析性能評估包括分析靈敏度、分析特異性、檢測范圍、測定準確性、批內不精密度、批間不精密度等項目。
分析性能評估結果是制定產品標準的重要基礎。研發者應當采用多批產品進行上述等項目的性能評估。通過對多批產品性能評估結果進行統計分析制定擬訂產品標準,以有效地控制產品生產工藝及產品質量的穩定。
如注冊申請中包括不同的包裝規格,或該產品適用不同機型,則需要采用每個包裝規格產品,或在不同機型上進行上述項目評估的試驗資料。
8、參考值(范圍)確定資料
應詳細說明確定參考值(參考范圍)所采用的樣本來源,說明參考值(參考范圍)確定的方法,并提供參考值(參考范圍)確定的詳細試驗資料。
9、穩定性研究資料
包括至少三批樣品在實際儲存條件下保存至成品有效期后的穩定性研究資料,必要時應當提供加速破壞性試驗資料。
10、臨床試驗資料
應當參考有關技術指導原則開展臨床試驗,并提供臨床試驗資料。
(1)臨床試驗協議及臨床試驗方案。
(2)各臨床試驗機構的臨床試驗報告、對所有臨床試驗結果的總結報告。各臨床試驗機構的試驗報告需加蓋臨床試驗主管部門公章。(包含騎縫章)
(3)附件:臨床試驗的詳細資料,包括所有臨床試驗結果、同時采用的其他試驗方法或其他診斷試劑產品的基本信息,如試驗方法、診斷試劑產品來源、產品說明書及注冊批準情況等。
注:對于校準品、質控品、參比液等不需提供臨床試驗資料。
11、生產及自檢記錄
提供連續三批產品生產及自檢記錄的復印件。
12、包裝、標簽樣稿
應當符合《醫療器械說明書、標簽和包裝標識管理規定》的要求。
產品外包裝上的標簽必須包括通用名稱、生產企業名稱、產品批號、注意事項。可同時標注產品的通用名稱、商品名稱和英文名。通用名稱應當符合《體外診斷試劑注冊管理辦法》中有關的命名原則。
對于體外診斷試劑產品中的各種組份如校準品、質控品、清洗液等,其包裝、標簽上必須標注該組份的中文名稱和批號。如果同批號產品、不同批號的各種組份不能替換,則既要注明產品批號,也要注明各種組份的批號。
13、質量管理體系考核報告
首次申請第二類產品注冊時,應當提供相應的藥品監督管理部門出具的質量管理體系考核報告。
注:各省申請資料有所不同,請按企業所在省局公布資料為準。
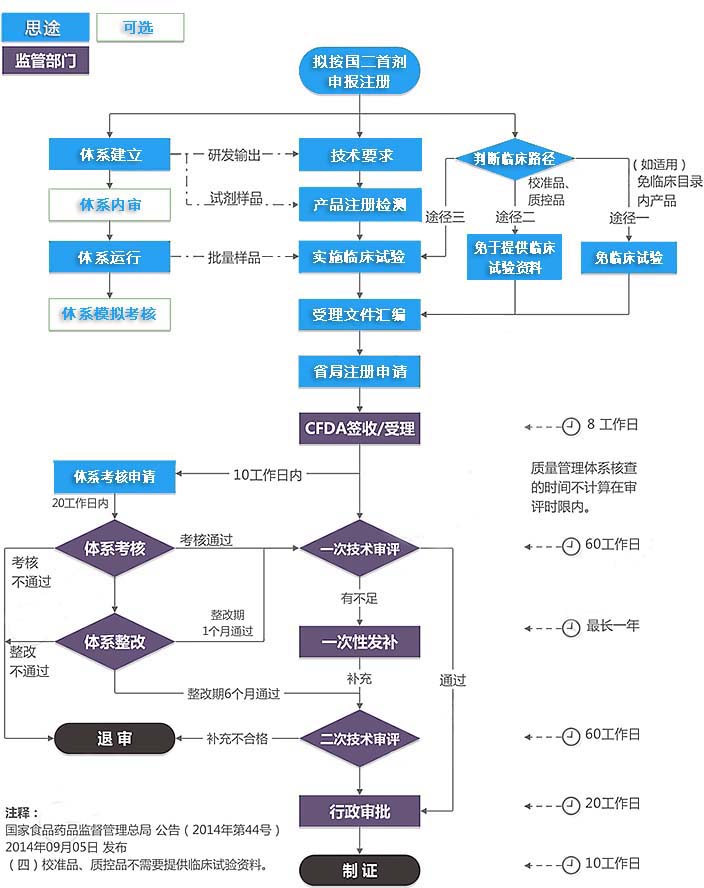
第二類IVD注冊證(首次注冊)服務流程
第二類IVD注冊證(首次注冊)收費標準
| 主管部門 | 管理類別 | 首次注冊 | 注冊變更 (許可事項變更) | 延續注冊 (五年一次) | 相關文件 | 實施日期 | ||
|---|---|---|---|---|---|---|---|---|
| 省 局 | 1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 閩發改服價函〔2021〕 361號 | 2021/9/1 |
| 2 | 江西省 | Ⅱ | 3.8272 | 1.602 | 1.587 | 贛發改價管〔2023〕670號 | 2023/11/1 | |
| 3 | 上海市 | Ⅱ | 2.3005.5 | 0.9628.5 | 0.9555 | 滬藥監公告﹝2024﹞1號 | 2024年4月1日 (截止25年12月31日) | |
| 4 | 海南省 | Ⅱ | 4.067 | 1.6856 | 1.6709 | 瓊發改收費〔2021〕424號 | 2021/6/15 | |
| 5 | 山東省 | Ⅱ | 4.6 | 1.92 | 1.9 | 魯發改成本[2022]761號 | 2022/9/30 (截止25年10月7日) | |
| 6 | 安徽省 | Ⅱ | 4.5045 | 1.4651 | 1.0395 | 皖發改價費函〔2024〕440號 | 2023/12/29 (截止26年1月1日) | |
| 7 | 浙江省 | Ⅱ | 4.6011 | 1.5405 | 1.5288 | 浙藥監械[2023]2號 | 2023/8/31 | |
| 8 | 山西省 | Ⅱ | 1.26 | 0.48 | 0.48 | 晉發改收費發〔2023〕361號 | 2023/9/18 | |
| 9 | 云南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 10 | 河北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 11 | 江蘇省 | Ⅱ | 5.915 小微企業免征 | 2.471 | 2.457 | 蘇發改收管發[2019]91號 | 2019/2/13 | |
| 12 | 寧夏 | Ⅱ | 0.75 | 0.325 | 0 | 寧發改價格(調控)函〔2025〕53號 | 2025/2/19 | |
| 13 | 黑龍江 | Ⅱ | 3.312 | 1.403 | 1.38 | 黑發改價格〔2020〕712 號 | 2024/6/10 | |
| 14 | 廣東省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粵發改價格函〔2019〕666號 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘發改價費規〔2024〕416號 | 2024/6/10 | |
| 16 | 四川省 | Ⅱ | 3.90 | 1.60 | 1.60 | 川發改價格〔2024〕585號 | 2024/12/1 (截止2029年12月1日) | |
| 17 | 貴州省 | Ⅱ | 2.145 | 0.88 | 0.88 | 黔發改價格〔2024〕787號 | 2024/12/31 | |
| 18 | 廣西 | Ⅱ | 2.0187 | 1.264 | 0 | 桂發改價費函〔2024〕1327號 | 2024/6/11 | |
| 19 | 遼寧省 | Ⅱ | 5 | 2.1 | 2.1 | 遼藥監告〔2023〕70號 | 2023/7/20 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政發〔2020〕4號 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 23 | 重慶市 | Ⅱ | 0 | 0 | 0 | 渝府辦發〔2019〕56號 | 2019/5/15 | |
| 24 | 甘肅省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 25 | 新疆 | Ⅱ | 0.28 | 0.24 | 0.12 | 新發改收費〔2024〕158 號 | 2024/4/18 | |
| 26 | 內蒙古 | Ⅱ | 0 | 0 | 0 | 內發改費字〔2019〕773號 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京發改[2019]569號 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 津黨發[2018]39號 | 2019/1/4 | |
| 29 | 陜西省 | Ⅱ | 0 | 0 | 0 | 陜財稅[2019]26號 | 2020/1/10 | |
更新時間:2025年5月6日
單位:萬元
第二類IVD注冊證(首次注冊)辦理依據
| 文件名稱 | 文號 |
|---|---|
| 《醫療器械監督管理條例》 | 650號文件 |
| 《體外診斷試劑注冊與備案管理辦法》 | 市場監督管理總局令第48號 |
第二類IVD注冊證(首次注冊)服務周期
立項階段
預算、合同、考慮期,約2個工作日。
產品檢測,平均4個月。(客戶自行送檢)
受理前資料準備
客戶資料對接(視客戶情況而定),至少3個工作日。
臨床試驗不可與檢測并行,臨床應單獨核算時間。至少6個月。
注冊資料編制可與檢測或臨床并行,資料編制約1個月。
受理后
省CFDA法定辦結時限3個月。(93個工作日,不計節假)
發補資料準備時限0~2個月視產品首次申報資料情況而定。平均1個月
*體系考核,注冊受理后,額外30工作日。需預留1.5個月。
預算合計
無臨床試驗國內二類IVD首次注冊 預算平均5個月
有臨床試驗國內二類IVD首次注冊 預算應考慮10個月。
第二類IVD注冊證(首次注冊)相關服務
| 注冊資料編寫服務 | 外聘專家審核注冊、臨床方案服務 |
| 發補資料整改服務 | 延伸:ivd臨床試驗服務 |
| 延伸:二類ivd注冊延續服務 | 延伸:生產許可代辦服務 |

立即咨詢
- 上一篇: 第二類醫療器械注冊證(首次注冊)服務
- 下一篇: 進口第二類醫療器械注冊證(首次注冊)服務
 最新文章
最新文章 2025-08-10
2025-08-10 2025-08-10
2025-08-10 2025-08-10
2025-08-10 2025-08-10
2025-08-10八年
醫療器械服務經驗
-
多一份參考,總有益處
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
- 在線咨詢
- 在線客服
- 服務熱線
北京公司
186-0382-3911鄭州公司
186-0382-3910合肥公司
188-5696-0331 - 微信咨詢

- 返回頂部










 豫公網安備 41010202003160號
豫公網安備 41010202003160號