

醫(yī)療器械生產(chǎn)企業(yè)合規(guī)技術咨詢服務
注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
186-0382-3910

進口三類體外診斷試劑注冊證(登記事項變更)服務
依據(jù)《體外診斷試劑注冊管理辦法》相關規(guī)定,第三類體外診斷試劑實行注冊管理,進口第三類體外診斷試劑由藥監(jiān)總局審查,批準后發(fā)給進口三類醫(yī)療器械注冊證。如進口醫(yī)療器械注...
服務價:¥電議
好評系數(shù):

依據(jù)《體外診斷試劑注冊管理辦法》相關規(guī)定,第三類體外診斷試劑實行注冊管理,進口第三類體外診斷試劑由藥監(jiān)總局審查,批準后發(fā)給進口三類醫(yī)療器械注冊證。如進口醫(yī)療器械注冊證載明的注冊人名稱和住所、代理人名稱和住所發(fā)生變化的,注冊人應當向原注冊部門申請進口醫(yī)療器械注冊證登記事項變更,并按照相關要求提交申報資料。
進口ivd注冊登記事項變更應附資料
1、注冊人關于變更情況的聲明;
2、原醫(yī)療器械注冊證及其附件復印件;
3、歷次醫(yī)療器械注冊變更文件復印件;
4、關于變更情況的申報資料要求:
(1)注冊人名稱變更提交企業(yè)名稱變更核準通知書(境內(nèi)注冊人)和/或相應詳細變更情況說明及相應證明文件。
(2)注冊人住所變更提交相應變更情況說明及相應證明文件。
(3)代理人變更提交注冊人出具的變更代理人聲明;變更后代理人的營業(yè)執(zhí)照副本復印件或機構登記證明復印件;注冊人出具的新代理人委托書、新代理人承諾書。
(4)代理人住所的變更提交變更前后營業(yè)執(zhí)照副本復印件或機構登記證明復印件。
5、境外注冊人注冊地或生產(chǎn)地址所在國家(地區(qū))醫(yī)療器械主管部門出具的新的允許產(chǎn)品上市銷售證明文件(如有)。
6、境外注冊人注冊地或生產(chǎn)地址所在國家(地區(qū))醫(yī)療器械主管部門出具的新的企業(yè)資格證明文件(如有)。
7、進口注冊人在中國境內(nèi)指定代理人的委托書;
8、代理人承諾書;
9、代理人營業(yè)執(zhí)照副本或者機構登記證明復印件;
10、符合性聲明和符合標準的清單;
11、注冊人所在地公證機構出具的關于原文/英文資料公證件其中5、6項如無,需要提交說明。
代理人變更申報資料要求
1、醫(yī)療器械注冊證變更/補辦申請表;
2、醫(yī)療器械注冊證書原件(申請變更時提交復印件,領取變更后的醫(yī)療器械注冊證書時交回原件);
3、生產(chǎn)企業(yè)出具的變更代理人的聲明;
4、生產(chǎn)企業(yè)給變更后代理人的委托書;
5、變更后代理人的營業(yè)執(zhí)照或者機構登記證明;
6、變更后代理人接受委托并承擔相應責任的承諾;
7、所提交材料真實性的自我保證聲明。
應當由生產(chǎn)企業(yè)或其在中國的代表處出具,聲明中應當列出提交材料的清單,并包括承擔法律責任的承諾。
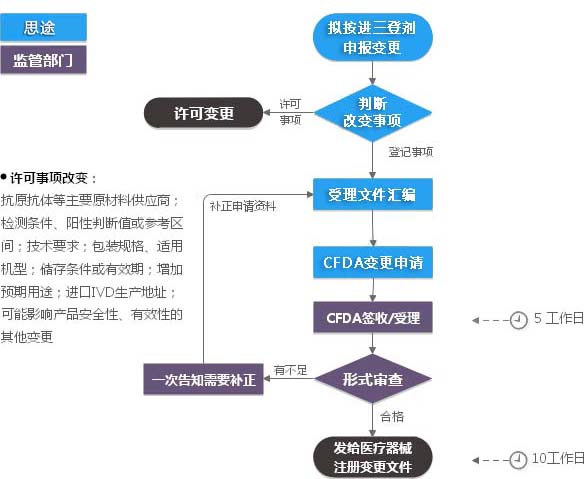
進口三類IVD注冊證(登記事項變更)服務流程
進口三類IVD注冊證(登記事項變更)收費標準
辦理進口三類IVD注冊證登記事項變更,官方不收取變更申請費用。
進口三類IVD注冊證(登記事項變更)辦理依據(jù)
| 文件名稱 | 文號 |
|---|---|
| 《醫(yī)療器械監(jiān)督管理條例》 | 650號文件 |
| 《體外診斷試劑注冊管理辦法》 | 局令5號 |
| 關于印發(fā)境內(nèi)第三類和進口醫(yī)療器械注冊審批操作規(guī)范 | 食藥監(jiān)械管〔2014〕208號 |
進口三類IVD注冊證(登記事項變更)服務周期
立項階段
預算、合同、考慮期,0.5個月。
受理前資料準備
資料收集 5工作日
申報資料撰寫 5工作日
資料確認、公證、蓋章 約8-10工作日
申請后
登記事項變更法規(guī)時間15個工作日,約1個月
預算合計
立項后,約1-2個月。
進口三類IVD注冊證(登記事項變更)推薦服務
| 進口三類IVD首次注冊服務 | IVD臨床試驗服務 |
| 進口創(chuàng)新器械申報服務 | 進口三類IVD注冊證延續(xù)服務 |

立即咨詢
 最新文章
最新文章 2025-08-10
2025-08-10 2025-08-10
2025-08-10 2025-08-10
2025-08-10 2025-08-10
2025-08-10八年
醫(yī)療器械服務經(jīng)驗
-
多一份參考,總有益處
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
- 在線咨詢
- 在線客服
- 服務熱線
北京公司
186-0382-3911鄭州公司
186-0382-3910合肥公司
188-5696-0331 - 微信咨詢

- 返回頂部








 豫公網(wǎng)安備 41010202003160號
豫公網(wǎng)安備 41010202003160號