淺談病例報(bào)告表設(shè)計(jì)/填寫與更正(附病例報(bào)告表模板)
病例報(bào)告表(CRF)是臨床試驗(yàn)中記錄臨床資料的表格,每一受試者有關(guān)試驗(yàn)的資料均應(yīng)記錄在預(yù)先按試驗(yàn)方案設(shè)計(jì)的病例報(bào)告表中。它們依據(jù)原始記錄而填寫,以便申辦者對不同試驗(yàn)單


注冊備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2024-04-17 閱讀量:次

受理號:CQZ2300053
產(chǎn)品中文名稱:一次性使用血液灌流器
產(chǎn)品管理類別:第三類
申請人名稱:天津優(yōu)納斯生物科技有限公司
國家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評中心
基本信息
一、申請人名稱
天津優(yōu)納斯生物科技有限公司
二、申請人住所
天津開發(fā)區(qū)黃海二街 9 號 A 區(qū)
三、生產(chǎn)地址
天津開發(fā)區(qū)黃海二街 9 號 A 區(qū)
技術(shù)審評概述
一、產(chǎn)品概述
(一)產(chǎn)品結(jié)構(gòu)及組成
本產(chǎn)品由柱體、吸附劑和填充液三部分組成。柱體由中筒、端蓋、密封蓋、壓蓋、框式濾網(wǎng)和密封圈組成,中筒、端蓋、壓蓋材質(zhì)為聚碳酸酯,密封蓋、濾網(wǎng)框架材質(zhì)為聚丙烯,濾網(wǎng)材質(zhì)為尼龍,濾網(wǎng)孔徑為150μm,密封圈材質(zhì)為硅橡膠。吸附劑為聚苯乙烯中性大孔樹脂,樹脂在 20-60nm 處孔徑分布最為集中,包膜材料為火棉膠。填充液為注射用水。產(chǎn)品經(jīng) γ 射線輻射滅菌,一次性使用。
(二)產(chǎn)品適用范圍
該產(chǎn)品與透析器配合使用進(jìn)行血液灌流治療,用于清除慢性腎衰竭患者體內(nèi)以 β2-微球蛋白(β2-MG)為代表的中大分子毒素物質(zhì),以及以硫酸吲哚酚(IS)、硫酸對甲酚(PCS)為代表的蛋白結(jié)合毒素物質(zhì)。
(三)型號/規(guī)格
產(chǎn)品型號:UUMM-80 UMM-130 UMM-300
產(chǎn)品規(guī)格:對應(yīng)吸附劑填充量 80mL 130mL 300mL
(四)工作原理
通過血液凈化裝置將患者的血液引入裝有大孔吸附樹脂的灌流器中,使血液直接與吸附樹脂接觸,通過樹脂的吸附作用和血液灌流的方法,清除慢性腎衰竭患者體內(nèi)含量過高的中大分子毒素、蛋白結(jié)合毒素。
二、臨床前研究概述
(一)產(chǎn)品性能研究
申請人參考同類產(chǎn)品并結(jié)合自身產(chǎn)品特點(diǎn),提供了產(chǎn)品性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說明,給出了物理性能、化學(xué)性能、吸附性能、生物性能以及與質(zhì)量控制相關(guān)的其他指標(biāo)的確定依據(jù)。產(chǎn)品技術(shù)要求中各指標(biāo)參考了相關(guān)國家、行業(yè)標(biāo)準(zhǔn),包括 YY/T 0464-2019 等。
(二)生物相容性
申請人依據(jù) GB/T16886.1-2011 對產(chǎn)品的生物相容性進(jìn)行了評價(jià)。按人體接觸性質(zhì)分類,該產(chǎn)品屬于外部接入循環(huán)血液器械;按接觸時(shí)間分類,屬于持久接觸(C)。申請人開展了生物學(xué)測試,進(jìn)行了熱原試驗(yàn)、溶血試驗(yàn)、凝血試驗(yàn)、血栓形成試驗(yàn)、血小板試驗(yàn)、補(bǔ)體激活試驗(yàn)、血液學(xué)試驗(yàn)、急性全身毒性試驗(yàn)、細(xì)胞毒性試驗(yàn)、皮膚致敏試驗(yàn)、皮內(nèi)反應(yīng)試驗(yàn)、鼠傷寒沙門氏菌回復(fù)突變試驗(yàn)、體外哺乳動物細(xì)胞染色體畸變試驗(yàn)、體外小鼠淋巴瘤試驗(yàn)、亞慢性全身毒性、植入試驗(yàn)。生物相容性風(fēng)險(xiǎn)可接受。
(三)滅菌
本產(chǎn)品為輻照滅菌,滅菌劑為 γ-射線。無菌保證水平為 10-6。
(四)產(chǎn)品有效期和包裝
該產(chǎn)品有效期為 2 年。申請人提供了加速老化和實(shí)時(shí)老化的有效期驗(yàn)證報(bào)告,包括產(chǎn)品穩(wěn)定性、包裝完整性和運(yùn)輸模擬驗(yàn)證資料。
(五)動物研究
申請人開展了以大耳白兔為模型的動物試驗(yàn)研究,以評估一次性使用血液灌流器用于動物血液灌流時(shí)的安全性。動物試驗(yàn)結(jié)果證明了一次性使用血液灌流器對小型動物血液灌流時(shí)的安全性。
三、臨床評價(jià)概述
本次申報(bào)通過臨床試驗(yàn)路徑開展臨床評價(jià),采用前瞻性、多中心、隨機(jī)、開放、三臂平行對照設(shè)計(jì),試驗(yàn)組為高通量透析器+申報(bào)產(chǎn)品灌流器,對照組 1 為高通量透析組(空白對照),試驗(yàn)組應(yīng)優(yōu)效于對照組 1;對照組 2 為高通量透析+已上市灌流器(陽性對照),試驗(yàn)組應(yīng)非劣效于對照組 2,共入組 360 例受試者,各組分別 120 例。試驗(yàn)組使用的高通量透析器均為同一款已上市產(chǎn)品。
臨床試驗(yàn)主要評價(jià)指標(biāo)為硫酸吲哚酚(IS)下降率(2h),硫酸對甲酚(PCS)下降率(2h),β2 微球蛋白(β2-MG)下降率(2h)。次要評價(jià)指標(biāo)為血肌酐、尿素下降率(2h、4h)、超濾率等;安全性指標(biāo)為患者一般狀態(tài)、自我感覺、體征變化、實(shí)驗(yàn)室檢查、生物相容性、血?dú)夥治觥⑵餍等毕菁安涣际录闆r等。
臨床試驗(yàn)結(jié)果顯示,試驗(yàn)組與對照組 1 主要評價(jià)指標(biāo),F(xiàn)AS 集,β2 微球蛋白(β2-MG)下降率(2h)組間差值為 9.98%,95%置信區(qū)間為[4.89%,15.08%];硫酸吲哚酚(IS)下降率(2h)組間差值為 18.66%,95%置信區(qū)間為[11.74%,25.57%];硫酸對甲酚(PCS)下降率(2h),組間差值為 13.85%,95%置信區(qū)間 為[8.90%,18.79%];下限均高于優(yōu)效界值 0。PPS集,試驗(yàn)組與對照組 1 的 β2 微球蛋白(β2-MG)下降率(2h)組間差值為 10.46%,95%置信區(qū)間為[5.47%,15.45%];硫酸吲哚酚(IS)下降率(2h)組間差值為 19.69%,95%置信區(qū)間為[1257%,26.81%];硫酸對甲酚(PCS)下降率(2h),組間差值為 14.56%,95%置信區(qū)間為[9.67%,19.66%];下限均高于優(yōu)效界值 0。
試驗(yàn)組與對照組 2 主要評價(jià)指標(biāo),F(xiàn)AS 集,β2 微球蛋白(β2-MG)下降率(2h)組間差值為 3.19%,95%置信區(qū)間為[-1.17%,7.55%],下限高于非劣效界值-10%;硫酸吲哚酚(IS)下降率(2h)組間差值為 14.50%,95%置信區(qū)間為[7.86%, 21.14%],下限高于非劣效界值-5%;硫酸對甲酚(PCS)下降率(2h),組間差值為 9.59%,95%置信區(qū)間為[5.19%,13.99%];下限均高于非劣效界值-9%。PPS 集,β2 微球蛋白(β2-MG)下降率(2h)組間差值為 2.84%,95%置信區(qū)間為[-1.30%,6.98%],下限高于非劣效界值-10%;硫酸吲哚酚(IS)下降率(2h)組間差值為 15.38%,95%置信區(qū)間為[8.39%,22.37%],下限高于非劣效界值-5%;硫酸對甲酚(PCS)下降率(2h),組間差值為 10.29%,95%置信區(qū)間為[5.66%,14..92%];下限均高于非劣效界值-9%。次要評價(jià)指標(biāo)及安全性指標(biāo)試驗(yàn)組與對照組未發(fā)現(xiàn)組間統(tǒng)計(jì)學(xué)差異。
臨床試驗(yàn)主要評價(jià)指標(biāo),試驗(yàn)組相較于對照組1(空白對照) 優(yōu)效假設(shè)成立,試驗(yàn)組相較于對照組2(陽性對照組)非劣效假設(shè)成立。
綜上,臨床評價(jià)資料符合技術(shù)審評要求。
四、產(chǎn)品受益風(fēng)險(xiǎn)判定
根據(jù)申請人提供的申報(bào)資料,經(jīng)綜合評價(jià),在目前認(rèn)知水平上,認(rèn)為該產(chǎn)品的上市為適用人群帶來的受益大于風(fēng)險(xiǎn)。
綜合評價(jià)意見
該產(chǎn)品為按照《醫(yī)療器械優(yōu)先審批程序》進(jìn)行審評的產(chǎn)品。申請人的注冊申報(bào)材料齊全。依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第 739 號)、《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第 47 號)等相關(guān)醫(yī)療器械法規(guī)與配套規(guī)章,經(jīng)系統(tǒng)評價(jià),申報(bào)產(chǎn)品符合安全性、有效性的要求,符合現(xiàn)有認(rèn)知水平,建議準(zhǔn)予注冊。
2024 年 3 月 21 日
來源:CMDE

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

病例報(bào)告表(CRF)是臨床試驗(yàn)中記錄臨床資料的表格,每一受試者有關(guān)試驗(yàn)的資料均應(yīng)記錄在預(yù)先按試驗(yàn)方案設(shè)計(jì)的病例報(bào)告表中。它們依據(jù)原始記錄而填寫,以便申辦者對不同試驗(yàn)單
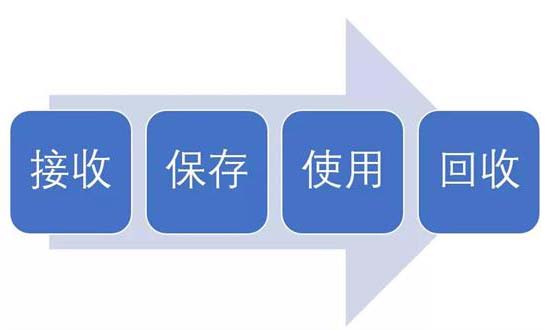
試驗(yàn)用藥品是指用于臨床試驗(yàn)的試驗(yàn)藥物、對照藥品。試驗(yàn)用藥品滲透到了臨床試驗(yàn)過程中的每一個(gè)步驟,包括藥物的生產(chǎn)、包裝、運(yùn)輸、保存、使用、回收等。今天我們從臨床試驗(yàn)中

從事醫(yī)療器械注冊的小伙伴們可能都為同一個(gè)問題苦惱過,那就是醫(yī)療器械注冊單元的劃分。企業(yè)所設(shè)計(jì)開發(fā)出的產(chǎn)品,其所包含的產(chǎn)品范圍,是否可通過一個(gè)注冊單元完成注冊,從而
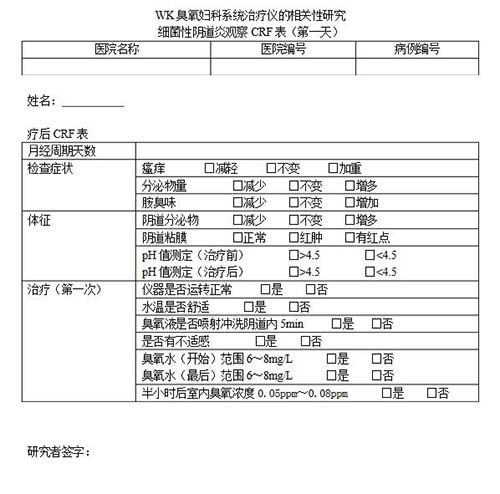
病例報(bào)告表(case report form,CRF)是按照臨床試驗(yàn)方案的要求設(shè)計(jì)的書面文件,用于記錄和報(bào)告每一名受試者在試驗(yàn)過程中的數(shù)據(jù),這種文件一般采用表格(紙質(zhì)或電子)的形式。"

醫(yī)療器械注冊證是依照法定程序,對擬上市銷售、使用的醫(yī)療器械的安全性、有效性進(jìn)行評價(jià),決定同意其銷售、使用后發(fā)放的證件,由國家食品藥品監(jiān)督管理總局統(tǒng)一制定。"
眾所周知,醫(yī)療器械分為三類,一類采用備案制,二三類采用注冊制管理,等級越高,管理越嚴(yán)格。一類醫(yī)療器械都是免臨床的,因此備案工作比較簡單不繁瑣。而二三類醫(yī)療器械除免臨床產(chǎn)品

醫(yī)用冷敷貼可以每天使用,但是不建議長期每天使用。醫(yī)用冷敷貼安全性比較高,而且功效也明顯,更適合皮膚出現(xiàn)問題的時(shí)候使用,如果皮膚沒有什么皮膚問題,使用起來可能和一般

根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第650號),第三類醫(yī)療器械注冊時(shí)需要提交產(chǎn)品的檢測報(bào)告,并且注冊申請資料中的產(chǎn)品檢測報(bào)告應(yīng)當(dāng)由具有承檢資格的醫(yī)療器械檢驗(yàn)機(jī)構(gòu)出具

我們都知道,一個(gè)醫(yī)療器械產(chǎn)品想要上市銷售除了辦理醫(yī)療器械生產(chǎn)許可證外,還需要辦理醫(yī)療器械注冊證,而三類醫(yī)療器械產(chǎn)品又屬于風(fēng)險(xiǎn)級別最高,管控級別也最嚴(yán),那么三類醫(yī)療器械產(chǎn)品

目前,臨床研究注冊的要求是,前瞻性隨機(jī)對照研究必須在研究開始前注冊,觀察性研究目前尚無統(tǒng)一要求,但有需要注冊的趨勢(脊柱外科前瞻性的研究不注冊,文章一般很難發(fā)表,
行業(yè)資訊
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
