海南博鰲樂城國際醫療旅游先行區醫療機構制劑調劑使用管理暫行辦法(瓊藥監注〔2020〕16號)
《海南博鰲樂城國際醫療旅游先行區醫療機構制劑調劑使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行。
來源:醫療器械注冊代辦 發布日期:2025-08-21 閱讀量:次
附件:結直腸癌篩查體外診斷試劑臨床評價注冊審查指導原則(2025年第16號).doc
本指導原則旨在指導注冊申請人對結直腸癌篩查試劑臨床評價資料的準備及撰寫,同時也為技術審評部門對臨床評價資料的技術審評提供參考。
本指導原則是針對結直腸癌篩查試劑臨床評價的一般要求,該類試劑應通過臨床試驗路徑進行臨床評價,申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件,但不包括審評審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。如果有能夠滿足相關法規要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下制定,隨著法規和標準的不斷完善,以及科學技術的不斷發展,相關內容也將適時進行調整。
本指導原則適用于對來源于人糞便樣本中的相關標志物進行體外檢測,用于結直腸癌篩查的體外診斷試劑。陽性結果提示可能存在結直腸癌或進展期腺瘤,應進行診斷性結腸鏡檢查;陰性結果不能完全排除疾病風險,特別是針對高風險人群,必要時仍應建議進行結腸鏡檢查。產品檢測結果不能替代結腸鏡。對于其他樣本類型,可能部分要求不完全適用或本文所述內容不夠全面,申請人可以參照本指導原則,根據產品特性對適用部分進行評價或補充其他的評價資料進行相應驗證。
開展結直腸癌篩查試劑臨床試驗應符合《體外診斷試劑注冊與備案管理辦法》《醫療器械臨床試驗質量管理規范》以及《體外診斷試劑臨床試驗技術指導原則》的要求,如相關法規、規章、規范性文件有更新,臨床試驗應符合更新后的要求。
申請人應根據產品特點確定適用人群,臨床試驗入組人群應對產品適用人群總體具有良好的代表性。應選擇不少于3家(含3家)符合法規要求的臨床試驗機構開展多中心臨床試驗。
參與臨床試驗的人員經培訓后應熟悉相關檢測技術的原理、預期用途、操作方法等,并能夠對檢測結果進行正確判讀。在整個試驗中,試驗體外診斷試劑和對比試劑/方法都應處于有效的質量控制下,最大限度保證試驗數據的準確性及可重復性。
臨床試驗應包括:對目標人群的篩查性能評價;對結直腸癌及進展期腺瘤診斷的靈敏度和特異度的分層評價;被測標志物的檢測性能評價等。
(一)對目標人群的篩查性能評價
1.受試者入組
篩查臨床試驗應在預期適用的目標人群中按照臨床試驗方案設定的入組標準前瞻性入組受試者。
結直腸癌篩查試劑的適用人群可能為一般風險人群或滿足一定年齡、性別要求的全人群,也可以是通過適當的判定標準選擇的高風險人群。應明確適用人群的判定依據。有關高風險人群和一般風險人群的定義建議按照現行有效的篩查指南執行。
入組人群應具有良好的目標人群代表性,包括人群基本特征和結直腸癌相關高風險因素的分布等方面。
受試者有無高風險因素等臨床背景信息應在臨床試驗數據表中進行描述,建議針對每一項風險因素單獨設一列。
為了保證入組受試者代表性和臨床試驗可操作性,可委托社區衛生服務機構、鄉(鎮)衛生院、基層疾病預防控制機構等進行受試者招募,注意應由臨床試驗機構進行委托,臨床試驗機構應對臨床試驗整體質量控制、臨床試驗數據的真實性與合規性負責;臨床試驗中的檢測分析(包括試驗體外診斷試劑檢測、對比方法或臨床參考標準涉及的檢測等)、數據管理及統計分析應由臨床試驗機構完成;受試者招募、知情同意書簽署、樣本采集等基礎操作過程可由社區衛生服務機構等完成;有關任務分工等應在臨床試驗方案中明確,由審查該臨床試驗的倫理委員會審查批準;臨床試驗機構應建立相關管理制度,明確各方職責,加強培訓和管理,確保臨床試驗結果真實、準確、完整和可追溯。
2.試驗方法
采用試驗體外診斷試劑與結直腸癌和進展期腺瘤臨床診斷參考標準,即結腸鏡結合病理檢查結果進行比較研究,評價試驗體外診斷試劑在適用人群中篩查結直腸癌和進展期腺瘤的靈敏度、特異度和陽性/陰性預測值等指標。
為了對篩查試驗結果進行更加科學的分析,臨床試驗中建議同時采用現行指南推薦的、與試驗體外診斷試劑的應用場景具有較好可比性的已有篩查方法(如糞便潛血檢測等)進行篩查,并將兩種篩查方法的臨床性能指標進行對比分析。即受試者入組后采用試驗體外診斷試劑和現行指南推薦的篩查方法分別進行檢測,之后進行結腸鏡檢查,必要時進行病理檢查。試驗體外診斷試劑與已有篩查方法的樣本采集應在結腸鏡檢查之前完成。
3.樣本量
應根據預期靈敏度水平,采用單組目標值法樣本量公式估算最低結直腸癌樣本例數。

公式中,n為陽性樣本量;Z1-α/2、Z1-β為顯著性水平和把握度的標準正態分布的分位數,P0為評價指標的臨床可接受標準,PT為試驗體外診斷試劑評價指標預期值。
基于已有認知,結直腸癌靈敏度P0建議不低于80%。
按照估算的最低結直腸癌樣本例數和預期適用人群中結直腸癌患病率估算總樣本量,同時考慮可能的受試者脫落比例,確定需要入組的受試者最低總樣本量。
4.統計學分析
首先應對入組人群基線信息進行總結分析,包括人口學信息,如年齡、性別、常住地域(農村,城市),以及風險因素分布等。入組人群應具有良好的目標人群代表性。
其次建議采用流程圖的形式說明入組人群、脫落人群、納入統計人群的情況,并對所有脫落病例進行分析,解釋脫落原因和脫落率可接受的理由。如有必要應進行脫落前后人群的基線差異分析。
最后對篩查試驗的各項臨床性能指標進行分析。評價指標一般包括臨床靈敏度、臨床特異度、陽性預測值、陰性預測值等。其中臨床靈敏度應針對結直腸癌和進展期腺瘤病例組分別評價,臨床特異度應針對非結直腸癌且非進展期腺瘤受試者進行評價。應針對各項評價指標進行點估計值及95%置信區間計算。此外計算入組人群中結直腸癌患者占比,應與同時期流行病學調查結果相符,同時計算各分期患者占比。
臨床試驗結果匯總和各項指標計算方法參見表1。

結直腸癌臨床靈敏度=a/(a+e)×100%
進展期腺瘤臨床靈敏度=b/(b+f)×100%
其他腺瘤檢出率=c/(c+g)×100%
臨床特異度=(g+h)/(c+d+g+h)×100%
陽性預測值=(a+b)/(a+b+c+d)×100%
陰性預測值=(g+h)/(e+f+g+h)×100%
如適用人群為滿足一定年齡、性別要求的人群,建議針對其中的一般風險人群和高風險人群進行分層分析,確認不同人群的篩查性能均滿足臨床要求。
產品如包括多項標志物,可針對各項標志物及多項標志物聯檢的篩查靈敏度進行分析,確認多項標志物聯合檢測的意義(如適用)。如果試驗體外診斷試劑不適用于此項評價,應有充分的理由。
建議同步開展已有篩查方法檢測,參照上述方法評價各項臨床性能指標。將試驗體外診斷試劑的各項臨床性能指標與已有篩查方法比較。
(二)結直腸癌及進展期腺瘤靈敏度和特異度的分層評價
1.受試者入組
為更加充分的評價試驗體外診斷試劑的靈敏度和特異度,還應對腫瘤組和非腫瘤組的重要亞組分別進行分層分析,使臨床性能評價更加全面地覆蓋目標人群中的各種特征,包括不同分期的腫瘤病例,和不同干擾因素的非腫瘤病例等。如前瞻性入組病例中某些亞組樣本量不足可進一步富集入組,富集入組病例不納入(一)部分的篩查性能評價。
1.1疾病組
疾病組人群應包括結直腸癌不同分期(Ⅰ、Ⅱ、Ⅲ、Ⅳ期)、結直腸進展期腺瘤患者,并針對不同亞組靈敏度進行分層分析。
1.2非疾病組
為對產品臨床特異度進行充分評價,應納入腸道良性疾病患者(腸息肉、腸腺瘤、腸炎、腸黑變病等)和其他消化道癌癥患者包括胃癌、肝癌、食管癌、膽管癌、胰腺癌等。
2.試驗方法
采用試驗體外診斷試劑與臨床診斷參考標準進行比較研究,評價試驗體外診斷試劑針對結直腸癌各分期、進展期腺瘤疾病組的臨床靈敏度,以及消化道良性疾病、其他腫瘤亞組的臨床特異度等指標。
3.臨床評價指標和樣本量
評價指標包括臨床靈敏度、臨床特異度以及各亞組的臨床靈敏度、臨床特異度。
依據臨床需求和已報道研究數據,部分關鍵亞組臨床性能評價指標推薦的最低可接受標準(95%置信區間下限)參下表:
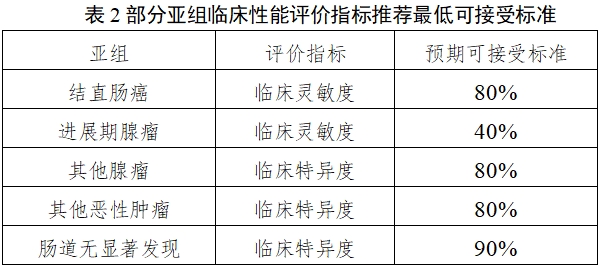
根據已有文獻數據,經統計學估算,建議結直腸癌病例不少于200例,其中各分期病例均應有一定例數,建議Ⅰ期不少于80例,Ⅱ期不少于50例;胃癌、肝癌、食管癌建議分別不少于30例,其他各種消化道癌癥亦均應有病例入組且總例數建議不少于30例。
4.統計學分析
對臨床試驗結果進行總結。計算靈敏度、特異度并計算95%置信區間;同時應針對結直腸癌不同分期、以及進展期腺瘤患者分別計算靈敏度;針對不同類型腸道良性疾病患者、其他不同癌種病例以及腸道無顯著發現患者分別分析特異度。
對于檢測結果與臨床診斷結論不一致的樣本,應結合患者疾病背景信息、其他臨床實驗室檢驗結果等對差異原因進行合理分析。
(三)被測標志物檢測性能評價
1.試驗方法
根據被測標志物的特征,應采用試驗體外診斷試劑與已上市同類產品或實驗室參考方法進行對比試驗,評價試驗體外診斷試劑針對被測標志物的檢測性能。例如被測標志物為DNA甲基化或者基因突變,可以采用測序方法作為實驗室參考方法,進行對比試驗。如選擇同類產品,應確認具有良好的可比性。實驗室參考方法應進行充分的性能驗證,包括最低檢出限、準確性、精密度等,確認與試驗體外診斷試劑具有良好的可比性,并提供詳細的方法建立和性能驗證資料。如測序試驗委托第三方實驗室或檢測機構完成,應提供臨床試驗機構委托該試驗的委托協議。
當試驗體外診斷試劑包含多項被測物時,原則上應針對所有標志物分別進行檢測性能評價。如不適用,應提供充分的理由和依據,并采用合理的方法進行檢測性能評價。
2.樣本量
應針對所有標志物(如適用)分別估算陽性樣本量和陰性樣本量,建議采用單組目標值法公式,目標值(P0)設定應有合理依據,基因突變或甲基化等核酸標志物檢測目標值建議不低于90%。
3.評價指標和統計學分析
對于試驗體外診斷試劑與對比試劑/方法的一致性評價,可采用四格表的形式總結兩種試劑/方法的檢測結果,計算陽性符合率、陰性符合率、總符合率及其95%置信區間。
對于不一致樣本,應進行原因分析。
(四)其他評價
在對申報產品各項臨床性能進行充分評價的基礎上,如有必要,申請人還可結合試驗體外診斷試劑預期用于目標人群的成本效果比以及受試者接受度等進行綜合分析,評價產品對篩查人群可能帶來的風險和獲益,并與已有篩查方法的風險和獲益進行比較,評價申報產品的優勢。此外建議申請人持續關注篩查頻率對篩查效果的影響。
(五)臨床試驗質量控制
1.方案設計的偏倚控制
不同的入組方式和入排標準會帶來入組人群的分布特征差異。為保證入組人群對篩查目標人群總體具有良好的代表性,臨床試驗方案應設置合理的入排標準,應分析目標人群的分布特征以及患病率等流行病學數據,以保證臨床試驗各人群占比結構合理性,避免帶來入組人群的選擇偏倚。
2.試驗實施質量控制
控制脫落率是保證臨床試驗質量和結論可靠性的基本要求。應重視受試者招募和入組,通過各種方式控制脫落率不能過高。對于臨床試驗中的脫落情況應詳細記錄原因,分析脫落人群的特征,以分析脫落對臨床試驗的影響。
良好的結腸鏡檢查質量和息肉活檢率是準確的臨床診斷參考標準的有效保證。結腸鏡檢查質量應符合臨床公認的高質量檢查標準,即良好的腸道準備、盲腸插鏡以及退鏡時間至少6分鐘。結腸鏡息肉均應進行活檢。
應注意試劑檢測和結腸鏡檢查的時間間隔。試驗體外診斷試劑與已有篩查方法(如采用)的樣本采集應在結腸鏡檢查之前完成,與結腸鏡檢查的時間間隔建議不超過12周,以降低偏倚風險,保障數據的可比性和結果的科學性。
[1]國家市場監督管理總局.體外診斷試劑注冊與備案管理辦法: 國家市場監督管理總局令第48號[Z].
[2]國家藥品監督管理局 國家衛生健康委員會.醫療器械臨床試驗質量管理規范:國家藥品監督管理局 國家衛生健康委員會2022年第28號[Z].
[3]國家藥品監督管理局.體外診斷試劑臨床試驗技術指導原則:國家藥品監督管理局2021年第72號[Z].
[4]中國結直腸癌篩查與早診早治指南 (2020,北京)[Z].
[5]中國結直腸癌診療規范(2023年版)國家衛生健康委員會[Z].
[6]結直腸癌篩查與早診早治方案(2024年版)國家衛生健康委員會[Z].
[7]U.S. Preventive Services Task Force. Screening for Colorectal Cancer. US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325(19):1965-1977.
[8]Wild CP ,Weiderpass E, Stewart BW. World Cancer Report: Cancer Research for Cancer Prevention.
[9]詹思延. 流行病學[M]. 第8版.人民衛生出版社, 2017.

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
《海南博鰲樂城國際醫療旅游先行區醫療機構制劑調劑使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行。

附件:血液透析用水處理設備注冊審查指導原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設備注冊審查指導原則(2024年修訂版)本指導原則旨在指導注冊申請人對血液透析用水處理設備注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對血液透析用水處理設備的一般要求,注冊申請人依據產品的具體特性確定其中內容是否適用。若不適用,要具體闡述理由及相應的科學依據,并依據產

國家藥監局關于發布免于進行臨床評價醫療器械目錄的通告(2025年第19號)發布時間:2025-05-13為做好醫療器械注冊管理工作,根據《醫療器械注冊與備案管理

本指導原則旨在幫助和指導注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術審評的基本要求。同時有助于審評機構對該類產品進行科學規范的審評,提高審評工

國家藥監局關于發布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據

國家藥監局藥審中心關于發布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發布日期:20241010

附件:醫療器械監督管理條例(2025年修訂版).doc醫療器械監督管理條例(2000年1月4日中華人民共和國國務院令第276號公布 2014年2月12日國務院第

附件:重組膠原蛋白創面敷料注冊審查指導原則(2023年第16號).doc重組膠原蛋白創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫重組膠原蛋白創

附件:醫用透明質酸鈉創面敷料注冊審查指導原則(2024年第21號).doc醫用透明質酸鈉創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫醫用透明質酸鈉創面敷料注冊申報資料,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對醫用透明質酸鈉創面敷料產品的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對

國家藥監局器審中心關于發布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發布時間:2024-10-14為進一步規范
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
