國內凝血分析流水線產品盤點(沃芬/希森美康/思塔高和艾科達)
隨著國家醫療改革的不斷深入,使得綜合性大中型醫療機構的中心實驗室對自動化系統有了新的要求,為了簡化檢測流程,提高檢測效率,保證數據準確度等,中心實驗室對集中化診斷
來源:醫療器械注冊代辦 發布日期:2025-08-25 閱讀量:次
為加強醫療器械監督管理,保障醫療器械產品質量安全有效,國家藥品監督管理局組織對平衡訓練設備、軟性接觸鏡等5個品種進行了產品質量監督抽檢,有6批(臺)產品不符合標準規定。具體情況通告如下:
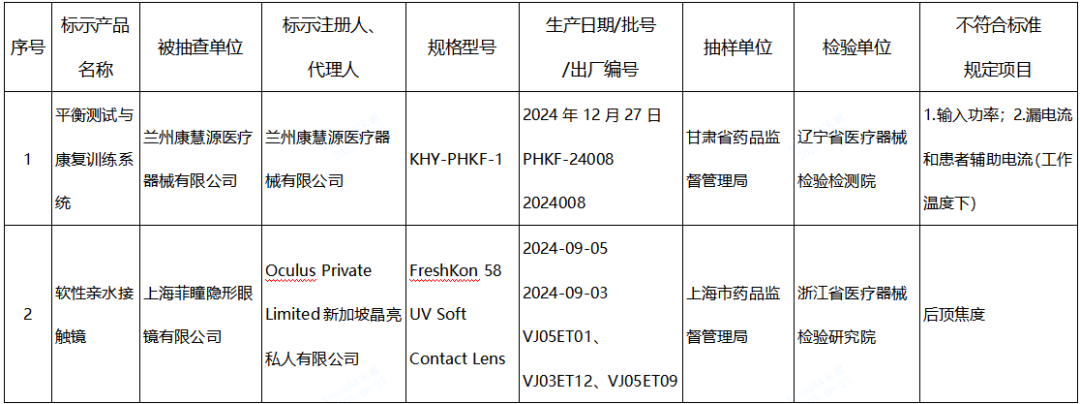
(一)平衡訓練設備產品1臺:蘭州康慧源醫療器械有限公司生產,涉及輸入功率、漏電流和患者輔助電流(工作溫度下)不符合標準規定。
(二)軟性接觸鏡產品1批:Oculus Private Limited新加坡晶亮私人有限公司生產,涉及后頂焦度不符合標準規定。
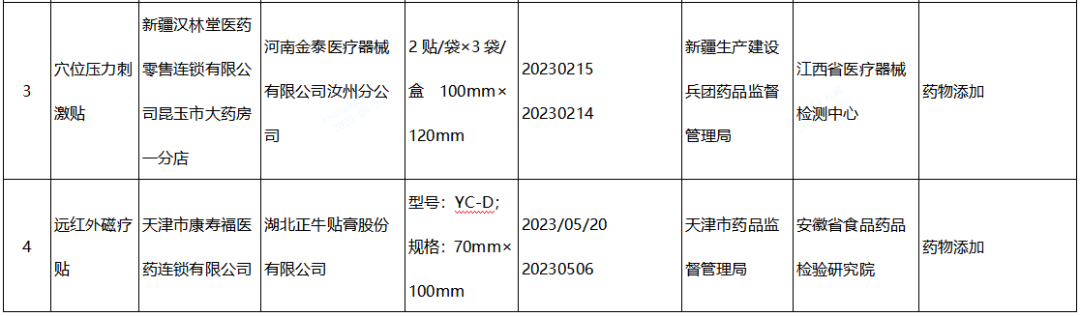
(三)貼敷類醫療器械(遠紅外治療貼、磁療貼、穴位磁療貼、退熱貼、穴位壓力刺激貼)2批:分別為河南金泰醫療器械有限公司汝州分公司、湖北正牛貼膏股份有限公司生產,涉及檢出“按照補充檢驗方法要求不得檢出的相關藥物成分”。
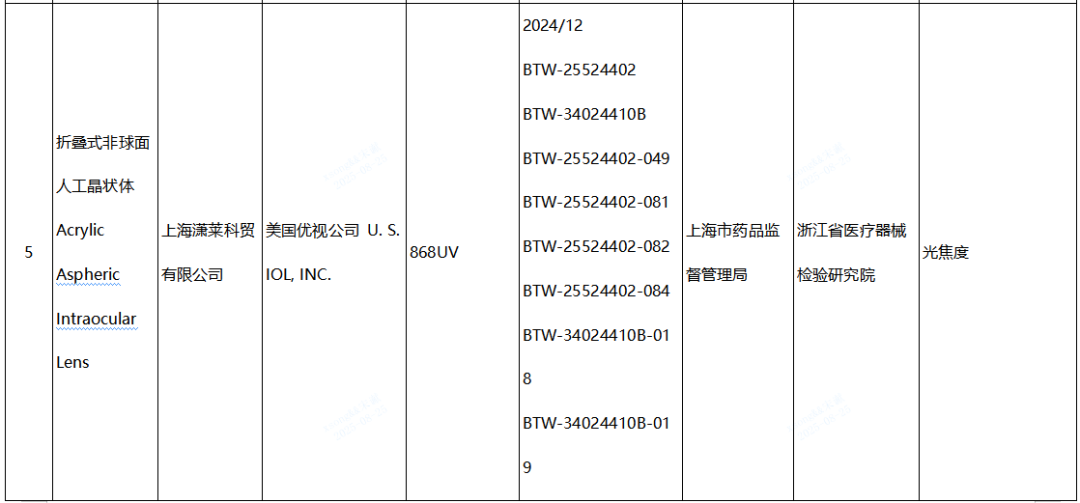
(四)人工晶狀體產品1批:美國優視公司 U. S. IOL, INC.生產,涉及光焦度不符合標準規定。
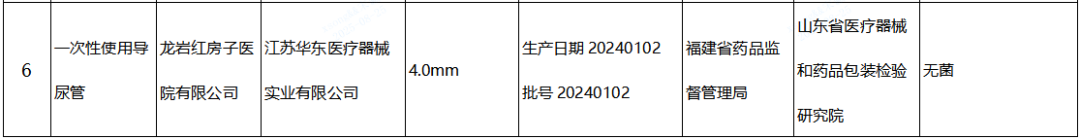
(五)一次性使用導尿管產品1批:江蘇華東醫療器械實業有限公司生產,涉及無菌不符合標準規定。
以上抽檢不符合標準規定產品具體情況見附件。
對抽檢發現的不符合標準規定產品,國家藥品監督管理局已要求企業所在地省級藥品監督管理部門按照《醫療器械監督管理條例》《醫療器械生產監督管理辦法》《醫療器械召回管理辦法》等要求,及時作出行政處理決定并向社會公布。省級藥品監督管理部門要督促企業對抽檢不符合標準規定產品進行風險評估,根據醫療器械缺陷的嚴重程度確定召回級別,主動召回產品并公開召回信息;督促企業盡快查明產品不合格原因,制定整改措施并按期整改到位。
特此通告。
附件:抽檢不符合標準規定產品名單
國家藥監局
2025年8月20日
附件
來源:NMPA

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

隨著國家醫療改革的不斷深入,使得綜合性大中型醫療機構的中心實驗室對自動化系統有了新的要求,為了簡化檢測流程,提高檢測效率,保證數據準確度等,中心實驗室對集中化診斷

FDA于2020.12.11發布了關于簡短(Abbreviated) 510(k)申請的相關產品指南,該指南是在遵守“基于安全有效性途徑”這一前提下編制提出的。在這個框架下,申請人若計劃使用安全有效性途徑提交

醫療器械注冊費是行政性收費,按照注冊單元收取,部分省份不收取醫療器械注冊費用,絕大部分省份還是收取的。本篇文章統計了截止到2022年1月5日各地醫療器械注冊收費標準。

潤滑劑類產品在美國根據產品預期用途的不同主要分為人體潤滑劑和患者潤滑劑:其中,人體潤滑劑主要成分為水、丙二醇、羥乙基纖維素、苯甲酸、卡波姆、氫氧化鈉等,作用于生殖

日前,國家藥監局發布《2018年度藥品監管統計年報》(以下簡稱《統計年報》),該報告數據來源于《藥品監督管理統計報表制度》,數據報告期為2017年12月1日至2018年11月30日。"

2016年起,醫療機構對有冷鏈要求的體外診斷試劑實施了入庫驗收制度,要求供應商按照醫院規定的時間將產品送到科室,必須由試劑管理部門驗收人員、科室人員雙方一起驗收,驗收要

以下對歐代、英代簡單介紹,下期將針對歐洲注冊、英國注冊的要求推出詳細的專題講解,包括符合性聲明、標簽、文件等。"

國家藥監局器審中心關于發布定性檢測體外診斷試劑分析性能評估等6項醫療器械產品注冊審查指導原則的通告(2022年第36號) 發布時間:2022-09-28 為進一步規范定性檢測體外診斷試劑分析

為貫徹落實省委省政府關于鼓勵支持醫療器械研究與創新的決策部署,加快創新醫療器械上市審批,促進新技術的推廣和應用,推動醫療器械產業高質量發展,江蘇省藥品監督管理局決

為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《關節鏡下無源手術器械產品注冊審查指導原則》《一次性使用輸尿管導引鞘注
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
