淺談病例報告表設計/填寫與更正(附病例報告表模板)
病例報告表(CRF)是臨床試驗中記錄臨床資料的表格,每一受試者有關試驗的資料均應記錄在預先按試驗方案設計的病例報告表中。它們依據原始記錄而填寫,以便申辦者對不同試驗單
來源:醫療器械注冊代辦 發布日期:2025-08-15 閱讀量:次
我們開發了一個軟件,專門用來檢查醫生寫好的醫療影像報告(比如CT報告、MRI報告)有沒有低級錯誤。比如,報告里寫的病人性別是男,但檢查部位明顯是女性生殖器官;或者病人年齡寫成了200歲,明顯不合理;又或者診斷意見里出現了自相矛盾的說法。說白了,它就是揪報告里那些“筆誤”、“手滑”或者明顯不合邏輯的文字錯誤。現在問題是:這種軟件,我們能按醫療器械去申請注冊證嗎?

不能!這種軟件國家不把它當醫療器械管。 為啥呢?咱得看看國家是怎么定義醫療器械的。國家《醫療器械監督管理條例》里說的清清楚楚:醫療器械是指那些直接或者間接用于人體的儀器、設備、工具、試劑、材料,還有相關的計算機軟件。這里最關鍵的詞是 “用于人體”!你這個軟件,它干的是啥活?它檢查的是醫生已經寫好的文字報告,是電腦里的一堆字符。它不碰病人的身體,也不直接分析病人的原始影像片子,更不參與診斷過程。它只是在報告生成之后,像個“文字校對員”一樣,看看有沒有明顯的文字錯誤、邏輯矛盾。它處理的對象是“報告文檔”,而不是“病人”本身。所以,它不符合“用于人體”這個最根本的要求。國家藥監局發布的《醫療器械分類目錄》和相關的軟件審查指導原則里,也找不到這種純文字校對軟件能歸屬的類別。它本質上就是個提高文書質量的辦公輔助軟件,跟醫院用的排班系統、病歷管理系統性質差不多,歸不到醫療器械的筐里。
為啥這種“文字校對”軟件不算醫療器械?核心在于它不干醫療器械該干的“醫療”活。醫療器械軟件,不管是獨立的還是嵌入設備的,它核心功能得跟疾病的診斷、預防、監護、治療或者緩解扯上直接關系。舉幾個例子你就明白了:比如一個軟件,它能自動分析CT片子,圈出腫瘤位置、測大小、甚至給出惡性可能性的概率,這直接影響診斷,是醫療器械(比如AI影像輔助診斷軟件)。再比如,一個軟件控制著呼吸機的參數,保證病人呼吸,這直接影響治療,是醫療器械。但你這個軟件呢?醫生已經看完了片子,得出了結論,寫好了報告。你的軟件只是在他寫完之后,檢查一下他寫的文字有沒有犯糊涂寫錯了性別、年齡或者前言不搭后語。它不改變診斷結果,不提供新的醫療信息,不參與任何診療決策。它對病人的影響是間接的、管理層面的(減少報告錯誤,提高質量),而不是直接的、醫療層面的。所以,它的風險性質和管理要求,跟真正用于診療的醫療器械軟件完全不同,國家自然不把它納入醫療器械監管范圍。
雖然不能當醫療器械注冊,但這軟件要是真有用,醫院還是能買能用的。不過,走的是非醫療器械軟件的路子:
1、市場路徑: 當成醫療信息化軟件或者醫院管理軟件來開發和銷售。醫院信息科采購這類軟件很常見。
2、合規要點:
(1)數據安全和個人信息保護是重中之重! 這軟件要處理病人的影像報告,里面全是敏感的個人健康和隱私信息。必須嚴格遵守《個人信息保護法》、《數據安全法》以及衛生部(衛健委)關于醫療數據管理的各種規定。怎么加密?怎么存儲?誰能訪問?怎么防泄露?這些都得做到位,否則出了事責任巨大。
(2)軟件本身的質量和可靠性: 雖然不按醫療器械審評,但作為醫院用的工具,總不能老死機、亂報錯吧?基本的軟件工程規范、測試、文檔還是要有,保證它能穩定運行,別給醫生添亂。
(3)明確功能邊界: 軟件說明書、宣傳材料里,千萬別說它有“輔助診斷”、“質量控制(指影像質量)”這類醫療功能!就老老實實說它是“報告文字規范性檢查工具”、“報告邏輯錯誤輔助識別工具”。別越界,避免誤導和監管風險。
3、別踩“變相醫療器械”的坑: 如果你給軟件加了一些“擦邊球”功能,比如:它不只是檢查文字錯誤,還偷偷地根據報告里的描述,自己生成一個診斷結論或建議;或者它直接去分析原始影像數據,然后說報告寫的不對…這就可能涉及醫療行為了,性質就變了,很可能又被納入醫療器械監管。所以,功能定位一定要清晰純粹,就是查文字錯誤。
最后總結三句話:
1、不能注冊成醫療器械,因為它只管醫生寫好的文字報告,不“用于人體”,也不參與核心診療。
2、本質是辦公軟件,走醫療信息化產品路線銷售給醫院,重點抓好數據安全和隱私保護。
3、功能千萬別越界,老老實實做“文字校對員”,別碰影像分析、別下診斷結論、別干擾診療流程,否則可能惹麻煩。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

病例報告表(CRF)是臨床試驗中記錄臨床資料的表格,每一受試者有關試驗的資料均應記錄在預先按試驗方案設計的病例報告表中。它們依據原始記錄而填寫,以便申辦者對不同試驗單
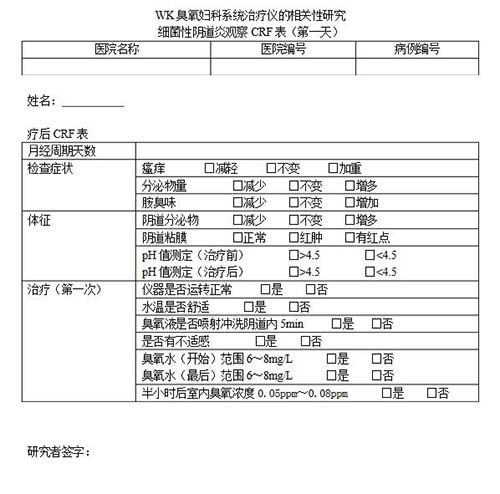
病例報告表(case report form,CRF)是按照臨床試驗方案的要求設計的書面文件,用于記錄和報告每一名受試者在試驗過程中的數據,這種文件一般采用表格(紙質或電子)的形式。"

世面上有醫用冷敷面膜和普通面膜之分,很多人認為這兩種面膜沒有本質上的區別,真是這樣嗎?醫用冷敷貼面膜能當普通面膜用嗎?會不會有副作用?

病例報告表 (CRF填寫指南) (第1版) 一、制定本指南目的: 為加強對醫療器械臨床研究的監督管理,保證臨床病歷報告表記錄真實、規范、完整,提高臨床試驗的質量,根據《醫療

醫療器械注冊檢驗報告的有效期,行業內常聽到各種說法,一起來看一下效期是怎么規定的。"
眾所周知,開展藥物臨床試驗必須提供臨床試驗用藥物的藥檢報告;同樣,申請醫療器械臨床試驗產品檢驗報告也是不可或缺的。只有檢驗合格,方可開展臨床試驗或者申請注冊、進行

如題所示,如何寫好監查報告?先看一下ICH-GCP1.38對于監查的定義:監督一個臨床試驗的發展,保證臨床試驗按照臨床方案、標準操作規程(SOP)、臨床試驗質量管理規范(GCP)和相應的
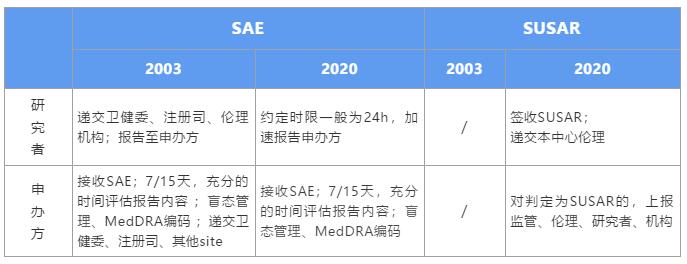
新版GCP對于申辦方的影響是全方位的,就SAE個例報告處理方面,強化了申辦方的主體責任,細化了申辦方對SAE的管理流程。在此,我們詳細解讀,在新規之下,該如何高效、合規的處理

目前,國家對經營第一類醫療器械的企業,既不要求備案,也不要求許可,全面放開;對經營第二類醫療器械的企業,則要求向市級進行備案;對經營第三類醫療器械的企業,要求必須

藥品零售企業是否實施GSP認證,被國際社會看成藥品經營質量有無保證的先決條件。能否正確把握《藥品零售企業GSP認證檢查評定標準》和《藥品零售企業GSP認證現場檢查項目》精"
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
