有源醫療器械加速老化試驗效期驗證及使用期限驗證流程
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
去年年底的一顆炸雷,威力震懾了整個醫療器械圈。這顆雷是什么?莫過于2020年12月21日國務院通過的《醫療器械監督管理條例》2020修訂版,那時圈內有消息稱年后必出正式稿,結果等了個寂寞。當這個消息已經無人關注的時候,某微信公眾號在小伙伴等待了將近4個月之久后,又一顆平地驚雷,文件一出,本人東看看國務院官網,西找找藥監局官網,愣是沒找到正式稿出處。在看完正式稿后,我懵了,修改稿中的二類上報國家局在這份文件中依舊是省局申報,持著將信將疑的態度,我盯了省局老師朋友圈一上午,對,一上午,在省局藥監老師轉發到朋友圈后,大徹大悟,沒錯就是它。

本篇文章我們重點關注臨床試驗機構備案方面內容,第二十六條提到:
開展醫療器械臨床試驗,應當按照醫療器械臨床試驗質量管理規范的要求,在具備相應條件的臨床試驗機構進行,并向臨床試驗申辦者所在地省、自治區、直轄市人民政府藥品監督管理部門備案。接受臨床試驗備案的藥品監督管理部門應當將備案情況通報臨床試驗機構所在地同級藥品監督管理部門和衛生主管部門。
醫療器械臨床試驗機構實行備案管理。醫療器械臨床試驗機構應當具備的條件以及備案管理辦法和臨床試驗質量管理規范,由國務院藥品監督管理部門會同國務院衛生主管部門制定并公布。
國家支持醫療機構開展臨床試驗,將臨床試驗條件和能力評價納入醫療機構等級評審,鼓勵醫療機構開展創新醫療器械臨床試驗。

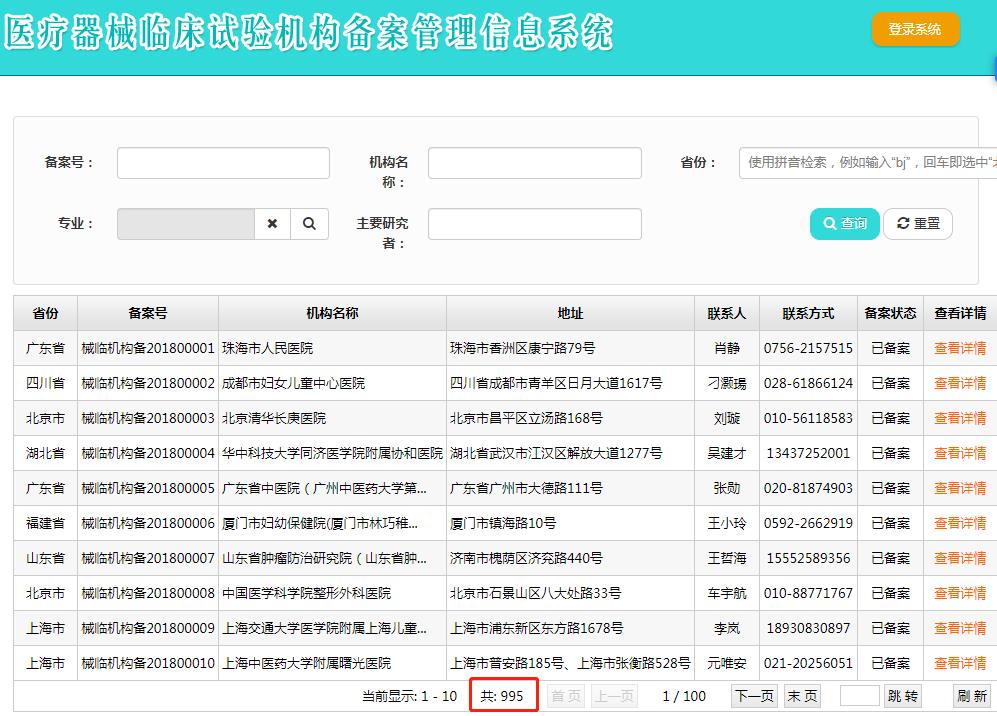
重點我給標紅了,(1)醫療器械臨床試驗機構實行備案管理;(2)國家支持醫療機構開展臨床試驗,將臨床試驗條件和能力評價納入醫療機構等級評審,鼓勵醫療機構開展創新醫療器械臨床試驗。不是所有醫療器械都需要臨床試驗,反過來想需要臨床試驗的醫療器械注冊上都會有點難度,畢竟臨床試驗項目生產企業并不擅長,CRO公司就此孕育而生。扯遠了,拉回來,說一下醫療器械臨床試驗機構備案的事,先看目前國內已備案的醫療器械臨床試驗機構數量,已經達到995家,藥物臨床試驗機構也有1085家了,在我的印象中,年前還相差著幾百,一轉眼已經進百了。原因我們就不去追究了,但可以看出醫療機構的熱情,都想在臨床試驗領域分取一杯羹。看看隔壁的山東省,鼓勵醫療器械辦理藥物臨床試驗機構備案,還有獎金,果然啥都是別人家的好。
開展醫療器械臨床試驗不僅可以支持國家醫療器械事業的發展、振興民族器械工業、保障人民健康且對醫療機構自身的發展和建設起到積極作用。
1、有利于醫院樹立品牌權威。提高公眾對醫院的評價,建立醫院在老百姓心中的威信,提升醫院的知名度和影響力,進一步實現社會效益和經濟效益兼顧。
2、有利于醫院開展循證醫學研究。循證醫學:是指臨床醫生對患者的診治都應該有充分的科學依據,任何決策都需建立在科學證據的基礎上,而這種科學也是當前最佳證據。近年來,醫患關系日趨緊張,采用循證醫學的原理和方法來規范醫療服務行為已越來越為人們的共識。
3、有利于提升醫院的科研水平。開展臨床試驗本身就是一項科學研究,開展臨床試驗為醫療機構提供很好的科研平臺,有利于機構多出成果,多出論文。臨床試驗至少會在兩家以上的機構進行試驗,有利于加強醫療機構與同行的合作、增加學術交流的機會,取人之長,補己之短,從而提高醫療機構的科研學術水平。
4、有利于醫護人員SCI論文的撰寫與發表。論文發表是學術成就的一種體現,可以提高自己的知名度,給同行提供學術性的價值參考,并有助于醫護人員評職稱和晉升。
5、有利于規范醫院的倫理工作。隨著國家涉及倫理的臨床工作及科學研究的審查越來越嚴格,以及患者醫療知識、法律意識的提高 ,倫理問題越來越突顯。通過臨床試驗機構的備案,更規范醫院的倫理工作。
6、有利于促進醫護人員合理用械。醫務人員參加一項臨床時,對該器械的療效、安全性、用法、療程及用器械的適應癥、禁忌癥等有較全面的了解,必然能夠更好地運用到患者身上,有利于規避醫療風險。
7、有利于增強醫務人員“以患者為中心”的服務理念。臨床試驗要求受試者入組前必須將實驗的詳細情況 告知受試者,并簽署知情同意書,實驗過程中如發生不良事件,研究者應該采取治療措施并及及時報告,整個過程要為受試者保密,整個過程都要求研究者處處為患者的利益著想。充分尊重患者的權利。增加了以患者為中心的服務理念,緩解了醫患關系緊張的局面。
8、有利于醫院引進科研人才。臨床試驗機構需要設立相關配套的獨立部門和科室,需要大量相關的專業科研人才,有利于醫院以全職和柔性相結合的形式,面向海內外公開招聘高端科研人才。
9、有利于醫院提高醫療能力。隨著科技水平不斷提高,大量創新型產品和治療手段衍生,有利于醫院開展和嘗試尚在臨床試驗階段的新型治療方案,從而大大提升醫療能力。
10、有利于醫院等級晉升。二級升二甲,二甲升三級,三級升三甲,審評標準有科研管理水平和科研平臺加分。
11、增加醫院收入水平等等.......
一不小心列出了十條,備案成功院長也感覺倍有面兒,哈哈......像我這種不要臉的還是少數哈。
最近思途也在推進臨床機構備案的事,正在合作的已經有幾家臨床機構了,達成戰略合作關系的也不少,CRO公司不缺臨床試驗單子,缺的是合作的臨床機構,這不我們來解決問題了,解決企業自身的問題,也幫忙解決醫院難辦的問題。最后,插播一條廣告,有藥物臨床試驗機構備案和醫療器械臨床試驗機構備案,你們又搞不定的,找我哦!
臨床試驗機構備案代辦服務

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有

在臨床過程中,異常值指檢測值超出了實驗室的正常值范圍。 有臨床意義(clinical significance,CS) 指檢查數值和正常標準值有差異,對臨床疾病的診斷具有一定的參考價值,而 無臨床

國家市場監管總局于官網公布《藥品注冊管理辦法》(以下簡稱“辦法”)已于2020年7月1日起正式施行。國家藥監局從《辦法》修訂的背景、思路、引入了哪些新理念和制度、有哪些鼓
中國是世界上最有潛力的醫療器械市場及最大市場之一,許多醫療器械進出口貿易商或國外有實力的企業希望能夠按照中國藥監局醫療器械注冊監管要求獲得中國市場的上市準入。考慮

醫療器械注冊費是行政性收費,按照注冊單元收取,部分省份不收取醫療器械注冊費用,絕大部分省份還是收取的。本篇文章統計了截止到2022年1月5日各地醫療器械注冊收費標準。

中國能排進世界十大醫療器械制造強國嗎?暫時還不能,因為排進前十的國家都有許多知名械企和世界級醫療器械巨頭;而中國比較出名的可能只有邁瑞了,其他械企仍需努力了。下面

2020年3月17日國家藥監局發布了關于醫療器械主文檔登記事項的公告(2021年第36號),之前給大家介紹過醫療器械主文檔的主要內容、適用的產品注冊類型等信息。今天我們再來向大家介

本文介紹了歐盟醫療器械新法規MDR相比于將替代的MDD法規的幾點新增要求。建議收藏學習。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)將替代原本的Medical Devices Directive (93

簡述了中藥新藥臨床試驗主要特點,指出要重視風險、受益評估,重視人 用經驗選擇科學、客觀、合適的有效性指標,做好中醫證候療效評價,鼓勵在中藥新藥臨床研究中采用電子化手

潤滑劑類產品在美國根據產品預期用途的不同主要分為人體潤滑劑和患者潤滑劑:其中,人體潤滑劑主要成分為水、丙二醇、羥乙基纖維素、苯甲酸、卡波姆、氫氧化鈉等,作用于生殖
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
