環(huán)氧乙烷滅菌介紹-常見滅菌方式之一
環(huán)氧乙烷滅菌是一種廣譜、高效、穿透力強(qiáng)、對(duì)消毒物品損害輕微的滅菌方法。環(huán)氧乙烷分子式C2H4O,分子量44.05。它的蒸氣壓比較大,可以穿透微孔而達(dá)到物品的深部。其液體和氣體均


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2023-10-10 閱讀量:次
?

2020年8月,歐盟委員會(huì)發(fā)布了MDR和IVDR法規(guī)下對(duì)于UDI系統(tǒng)使用的常見問題解答,小編對(duì)其梳理和總結(jié)如下:
Q1:什么是UDI?
UDI是指通過全球可接受的器械識(shí)別和編碼標(biāo)準(zhǔn)創(chuàng)建的一系列數(shù)字或字母字符,用于清晰的識(shí)別市場(chǎng)上特定的醫(yī)療器械。UDI包含UDI-DI和UDI-PI,UDI-DI提供器械的信息,UDI-PI提供器械生產(chǎn)者的信息。
Q2:什么是basic UDI-DI?
basic UDI-DI是EUdamed數(shù)據(jù)庫中與器械相關(guān)信息的主要訪問途徑,相關(guān)文檔中均會(huì)引用,比如證書(包括免費(fèi)銷售證書)、歐盟符合性聲明、技術(shù)文件和安全和(臨床)性能摘要。basic UDI-DI旨在識(shí)別和連接具有相同預(yù)期用途、風(fēng)險(xiǎn)等級(jí)和基本設(shè)計(jì)和制造特性的器械。它獨(dú)立于設(shè)備的包裝/標(biāo)簽,不出現(xiàn)在任何貿(mào)易信息上。任何basic UDI-DI應(yīng)以特有的方式識(shí)別該basic UDI-DI所涵蓋的器械或者器械組。
Q3:哪些器械受UDI的限制和約束?
除了定制和性能研究/研究設(shè)備外,UDI系統(tǒng)應(yīng)適用于所有其他設(shè)備。
Q4:誰有責(zé)任將UDI載體標(biāo)記在設(shè)備、標(biāo)簽或設(shè)備包裝上?
制造商有責(zé)任遵守所有與UDI相關(guān)的要求,這包括UDI的分配和UDI在Eudamed數(shù)據(jù)庫中的注冊(cè)(均包含basicUDI),UDI載體應(yīng)在設(shè)備的標(biāo)簽或包裝上,如為可重復(fù)使用器械,則應(yīng)標(biāo)記在設(shè)備本身(直接標(biāo)記)。
4.1.根據(jù)MDR和IVDR的第16條,經(jīng)濟(jì)運(yùn)營(yíng)商對(duì)UDI承擔(dān)有哪些義務(wù)?
根據(jù)第16(1)所述,承擔(dān)制造商義務(wù)的任何經(jīng)銷商、進(jìn)口商或其他自然人或法人,應(yīng)承擔(dān)所有與UDI相關(guān)的責(zé)任,包括UDI標(biāo)簽。
對(duì)設(shè)備轉(zhuǎn)移或再包裝的經(jīng)銷商或進(jìn)口商應(yīng)確保:
在實(shí)施該活動(dòng)的過程中不會(huì)對(duì)UDI損壞及不影響產(chǎn)品信息的識(shí)別;
且實(shí)施過程是經(jīng)銷商或進(jìn)口商質(zhì)量管理體系的一部分。
Q5:系統(tǒng)和程序包UDI注冊(cè)的流程?
系統(tǒng)和程序包應(yīng)根據(jù)MDR Article 29(2)所述進(jìn)行UDI注冊(cè)。
產(chǎn)品上市前,系統(tǒng)或程序包生產(chǎn)商應(yīng)當(dāng)分配基本UDI-DI,并提供Eudamed數(shù)據(jù)庫中列出的其他相關(guān)核心數(shù)據(jù)元素。
Q6:UDI要求的強(qiáng)制實(shí)施時(shí)間?
UDI的分配:自兩項(xiàng)新法規(guī)強(qiáng)制實(shí)施之日起使用,即MDR于2021年5月26日適用,IVDR于2022年5月26日起適用。
Eudamed數(shù)據(jù)庫提交UDI:MDR于2022年11月26日起適用,IVDR于2023年11月26日起適用。(前提條件是EUDAMED數(shù)據(jù)庫于適用日期之前正常運(yùn)行;否則本義務(wù)在EUDAMED正常運(yùn)行后24個(gè)月內(nèi)生效)。
器械UDI載體:
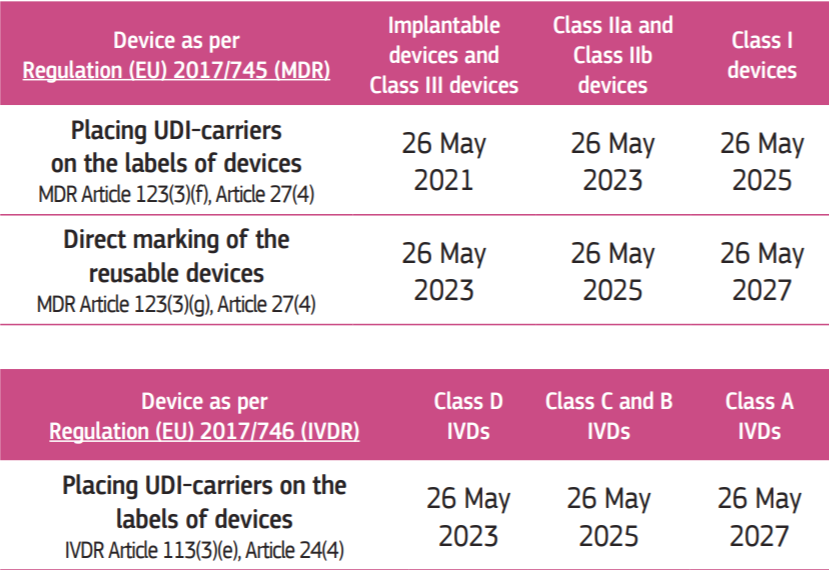
Q7:符合MDD或AIMDD的器械在MDR強(qiáng)制施行后需要遵循UDI要求嗎?
MDR給予足夠的過渡時(shí)間(截止至26 May,2024),以便于取得MDD或者AIMDD指令下CE認(rèn)證證書的器械的升級(jí)。這些符合舊的指令的醫(yī)療器械不受UDI約束,但是應(yīng)該在Eudamed數(shù)據(jù)庫中注冊(cè)。如問題6所述的注冊(cè)時(shí)間也適用于這些器械。
Q8:UDI發(fā)行實(shí)體的作用是什么?誰來指定?
UDI發(fā)行實(shí)體負(fù)責(zé)操作UDI系統(tǒng)并實(shí)施UDI的分配。
根據(jù)2018年底發(fā)起的申請(qǐng)呼吁,歐盟委員會(huì)指定了下列實(shí)體:

Q9:UDI應(yīng)該以怎樣的形式出現(xiàn)在標(biāo)簽或者包裝上?
UDI載體(UDI中的AIDC和HRI)應(yīng)在標(biāo)簽或器械本身以及所有更高級(jí)別的器械包裝上。如空間受限制,UDI載體可以放置在下一個(gè)更高級(jí)別的包裝上。更高級(jí)別的包裝應(yīng)該有自己特定的UDI。(Note:海運(yùn)集裝箱不需要UDI)
UDI必須是純文本/人可讀信息(HRI),且應(yīng)以AIDC的技術(shù)形式出現(xiàn)。AIDC是指可通過自動(dòng)化過程輸入電子病歷或其他計(jì)算機(jī)系統(tǒng)的形式傳遞設(shè)備唯一標(biāo)識(shí)或設(shè)備標(biāo)識(shí)符的任何技術(shù)。HRI由易讀的字符組成,便于人們閱讀。
如果在標(biāo)簽上同時(shí)使用AIDC和HRI空間限制,則只要求在標(biāo)簽上顯示AIDC格式。然而對(duì)于擬用于醫(yī)療保健環(huán)境以外的器械,如家庭護(hù)理器械,應(yīng)在標(biāo)簽上顯示HRI,盡管可能會(huì)因此導(dǎo)致AIDC空間受限。
一次性使用的、獨(dú)立包裝和標(biāo)識(shí)的Class I and IIa類以及class A and class B IVD醫(yī)療器械,獨(dú)立包裝上可以不放置UDI,但UDI應(yīng)當(dāng)出現(xiàn)在更高級(jí)別的包裝上,例如包含幾個(gè)(或單個(gè))器械的紙箱。但是,如無法訪問更高一級(jí)別的包裝,如家庭使用醫(yī)療器械,則UDI應(yīng)放在(單個(gè)設(shè)備的)包裝上。如專為零售點(diǎn)銷售的器械,不應(yīng)要求AIDC中的UDI-PI出現(xiàn)在銷售點(diǎn)包裝上。
如果UDI載體是易讀的,例如AIDC可通過器械的包裝進(jìn)行掃描識(shí)別,則不需要將UDI載體放置在包裝上。
Q10:PI(生產(chǎn)單位識(shí)別信息)有什么要求?
如果標(biāo)簽上有批號(hào)、序列號(hào)、軟件標(biāo)識(shí)號(hào)或有效期,則該標(biāo)簽應(yīng)作為UDI-PI的一部分;如果標(biāo)簽上同時(shí)包含生產(chǎn)日期,則這些信息不需要包含在UDI-PI中。如果標(biāo)簽上只有一個(gè)生產(chǎn)日期,則其可作為UDI-PI。
不同類型的UDI-PIs包括序列號(hào)、批號(hào)、軟件標(biāo)識(shí)號(hào)和生產(chǎn)日期和/或失效日期。
UDI-PI的特性,如批號(hào)或序列號(hào)應(yīng)由制造商定義,然而:
對(duì)于有源植入類器械,UDI-PI至少應(yīng)包括序列號(hào);對(duì)于其他可植入器械,應(yīng)包含序列號(hào)或批號(hào)。 應(yīng)將一個(gè)可配置器械的UDI-PI分配給每個(gè)單獨(dú)的可配置器械。
Note:UDI數(shù)據(jù)庫中不能包含任何UDI-PI信息。
Q11:醫(yī)療器械的哪些變化需要引入一個(gè)新的UDI-DI?
當(dāng)醫(yī)療器械的變化可導(dǎo)致對(duì)器械的錯(cuò)誤識(shí)別和/或在器械可追溯性中出現(xiàn)歧義時(shí),需要一個(gè)新的UDI-DI。特別是下列信息的改變:名稱或貿(mào)易名、設(shè)備版本或型號(hào)、一次性使用、無菌包裝、使用前需消毒、包裝的數(shù)量、警告語、禁忌癥或CMR /內(nèi)分泌干擾物等。
一個(gè)UDI-DI只能關(guān)聯(lián)一個(gè)Basic UDI-DI。
Q12:經(jīng)濟(jì)運(yùn)營(yíng)商和醫(yī)療衛(wèi)生機(jī)構(gòu)對(duì)于UDI的義務(wù)?
根據(jù)MDR和IVDR醫(yī)療器械法規(guī),制造商應(yīng)負(fù)責(zé)UDI的分配、UDI載體使用以及在Eudamed數(shù)據(jù)庫中初始提交和更新器械識(shí)別信息和其他數(shù)據(jù)元素。在不需要引入新的UDI-DI的情況下,制造商應(yīng)在信息改變后的30天內(nèi)更新相關(guān)數(shù)據(jù)庫記錄。
分銷商和進(jìn)口商應(yīng)核實(shí),在適用的情況下,生產(chǎn)廠商已分配UDI。
如果是III類植入式器械,所有經(jīng)濟(jì)運(yùn)營(yíng)商和醫(yī)療衛(wèi)生機(jī)構(gòu)應(yīng)儲(chǔ)存、且最好以電子方式保存其供應(yīng)的或被供應(yīng)的器械的UDI。委員會(huì)可通過實(shí)施法案擴(kuò)大經(jīng)濟(jì)運(yùn)營(yíng)商儲(chǔ)存UDI的器械的范圍。
Q13:軟件是否需要遵守UDI準(zhǔn)則?
UDI在軟件的系統(tǒng)級(jí)別進(jìn)行分配。
只有可自行購(gòu)買的軟件和本身就是器械的軟件才應(yīng)遵循該要求。
軟件標(biāo)識(shí)應(yīng)視為制造控制機(jī)制,并顯示在UDI-PI中。
作者:薛小青

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

環(huán)氧乙烷滅菌是一種廣譜、高效、穿透力強(qiáng)、對(duì)消毒物品損害輕微的滅菌方法。環(huán)氧乙烷分子式C2H4O,分子量44.05。它的蒸氣壓比較大,可以穿透微孔而達(dá)到物品的深部。其液體和氣體均

本文介紹了歐盟醫(yī)療器械新法規(guī)MDR相比于將替代的MDD法規(guī)的幾點(diǎn)新增要求。建議收藏學(xué)習(xí)。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)將替代原本的Medical Devices Directive (93

簡(jiǎn)述了中藥新藥臨床試驗(yàn)主要特點(diǎn),指出要重視風(fēng)險(xiǎn)、受益評(píng)估,重視人 用經(jīng)驗(yàn)選擇科學(xué)、客觀、合適的有效性指標(biāo),做好中醫(yī)證候療效評(píng)價(jià),鼓勵(lì)在中藥新藥臨床研究中采用電子化手

一個(gè)產(chǎn)品帶有CE 標(biāo)志(標(biāo)記) 也就意味著其制造商宣告:該產(chǎn)品符合歐洲的健康、安全、與環(huán)境保護(hù)之相關(guān)法律中所規(guī)定 的基本要求。因而該產(chǎn)品是對(duì):使用者(譯者注:人)、寵物(
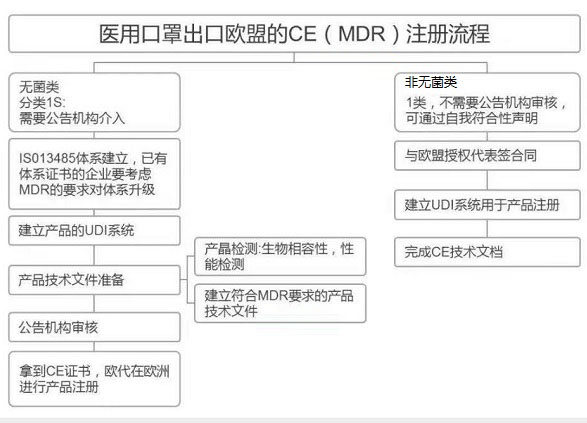
分享一下公司國(guó)外認(rèn)證部門的醫(yī)用口罩CE辦理的流程和要求圖,幫助大家正確了解醫(yī)用口罩的CE注冊(cè)路徑和要求。感謝很多跟我一樣傳播正能量的同行,一起努力幫助大家正確認(rèn)識(shí)CE注冊(cè)流程。

以下對(duì)歐代、英代簡(jiǎn)單介紹,下期將針對(duì)歐洲注冊(cè)、英國(guó)注冊(cè)的要求推出詳細(xì)的專題講解,包括符合性聲明、標(biāo)簽、文件等。"
相比無菌醫(yī)療器械更強(qiáng)調(diào)生產(chǎn)過程管控及質(zhì)量檢驗(yàn),有源醫(yī)療器械注冊(cè)對(duì)產(chǎn)品定位、注冊(cè)單元、典型型號(hào)、設(shè)計(jì)開發(fā)的等前期工作的要求要更高一些,本位為您帶來藥監(jiān)總局有關(guān)有源醫(yī)

近期,申請(qǐng)醫(yī)用口罩、防護(hù)服、額溫計(jì)等應(yīng)急第二類醫(yī)療器械注冊(cè)證的企業(yè)和客戶較多,因此,帶大家一起來回顧一下2019年下半年浙江省藥監(jiān)局發(fā)布的有關(guān)生物學(xué)和EMC檢測(cè)方面的官方解
醫(yī)療器械注冊(cè)電子申報(bào)信息化系統(tǒng)(eRPS)啟用說明,為落實(shí)中共中央辦公廳、國(guó)務(wù)院辦公廳《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號(hào)),國(guó)家藥品

近日,醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)相關(guān)兩個(gè)大事件,一是藥監(jiān)總局發(fā)布醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)數(shù)據(jù)庫,一是上海藥品監(jiān)督管理局發(fā)布關(guān)于印發(fā)《上海市推進(jìn)醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)試點(diǎn)工作方
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
