化妝品生產經營監督管理辦法(國家市場監督管理總局令第46號)
《化妝品生產經營監督管理辦法》已經2021年7月26日市場監管總局第12次局務會議通過,現予公布,自2022年1月1日起施行。
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
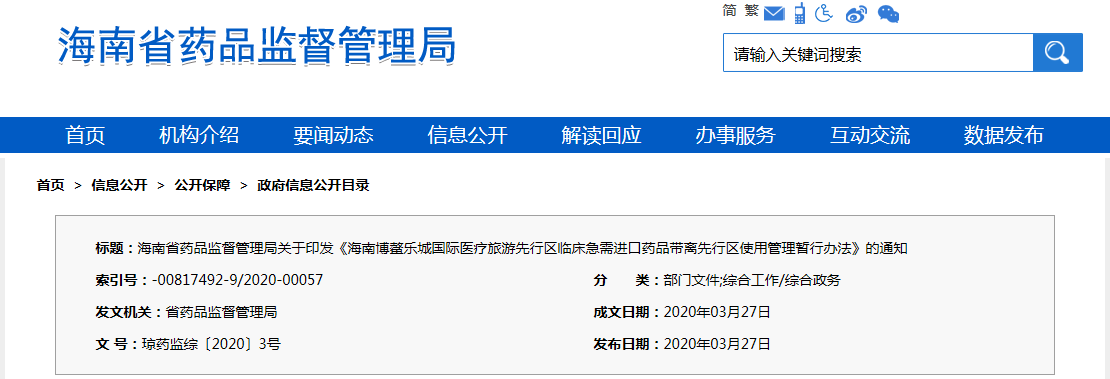
瓊藥監綜〔2020〕3號
海南博鰲樂城國際醫療旅游先行區各相關醫療機構:
《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行。
附件:海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法(瓊藥監綜〔2020〕3號).doc
海南省藥品監督管理局
2020年3月27日
(此件主動公開)
第一條 根據《關于支持建設博鰲樂城國際醫療旅游先行區的實施方案》,為便于海南博鰲樂城國際醫療旅游先行區(以下簡稱“先行區”)患者使用臨床急需進口藥品,解決患者每次使用臨床急需進口藥品必須住院問題,在患者承諾臨床急需進口藥品僅供自用的基礎上,實行將臨床急需進口藥品帶離先行區,制定本辦法。
第二條 本辦法所指的臨床急需進口藥品帶離先行區為先行區醫療機構患者出院時,由醫療機構根據患者需繼續使用臨床急需進口藥品的實際情況,制定患者出院帶藥方案及應急預案,經省衛生健康主管部門審批,省藥品監管部門批準后,患者可將僅供自用、少量的口服臨床急需進口藥品帶離先行區,帶離先行區的藥品為患者已獲批的臨床急需進口藥品。
第三條 首次使用臨床急需進口藥品須住院使用。
醫療機構應視患者病情確認患者出院帶藥的必要性及用藥的安全性,需出院帶藥的,須制定出院帶藥方案及應急預案。出院帶藥方案應明確處方醫生身份、出院帶藥量、患者再次就診給藥等注意事項;應急預案應明確患者口服臨床急需進口藥品期間,可能出現的不良反應的應對措施、急救方案等。
第四條 醫療機構按“一患者一申請”提出出院帶藥申請,并附出院帶藥方案及應急預案報省衛生健康主管部門審批。
第五條 省衛生健康主管部門在2個工作日內對出院帶藥方案及應急預案進行審批。符合要求的,出具審批意見。
第六條 省藥品監管部門在2個工作日內對經省衛生健康主管部門審批通過的出院帶藥方案進行審批。
第七條 患者對臨床急需進口藥品出院帶藥履行誠信義務。患者須簽署出院帶藥知情同意書及承諾書,承諾臨床急需進口藥品僅供自用,并配合監管和監測工作。患者帶藥出院后每次服用臨床急需進口藥品應視頻實時記錄,并附帶具備日期特征的背景物(如當日報紙或電視等),并當日內上傳至先行區進口藥械追溯系統。
醫療機構須安排專人查看患者每次服藥視頻,并根據患者病情,定期開展回訪,制定復診周期,指導患者服藥,及時記錄。若發現患者存在用藥安全隱患或沒有及時上傳用藥情況的,應啟動應急預案,及時采取補救措施,并及時將有關情況報給省衛生健康主管部門和省藥品監管部門。
第八條 醫療機構須確保患者帶離先行區使用的臨床急需進口藥品的外包裝為不完整包裝,并在內包裝及說明書上標注僅供XX(患者姓名)使用。醫療機構亦可使用新包裝,代替原藥品的外包裝,但須在新包裝上標注藥品名稱、有效期、貯存條件及用藥指導等。
第九條 醫療機構須主動開展藥品不良反應(ADR)監測及上報工作。
第十條 醫療機構須每季度向省衛生健康主管部門和省藥品監管部門報送出院帶藥使用情況。
第十一條 醫療機構承擔臨床急需進口藥品流弊主體責任。
患者帶離先行區的臨床急需進口藥品發生流弊的,第1次,1年內不再受理該醫療機構或該處方醫師出院帶藥申請;第2次,1年內不再受理該醫療機構申報臨床急需進口藥品申請;第3次,不再受理該醫療機構申報臨床急需進口藥品申請。
醫療機構擅自將臨床急需進口藥品帶離先行區的,不再受理該醫療機構申報臨床急需進口藥品申請,并依法追究其相關法律責任。
第十二條 醫療機構違反本辦法第七條第二款規定,將不再受理該醫療機構出院帶藥申請。
第十三條 患者不配合監管工作或發現患者將臨床急需進口藥品出售或轉贈他人等違規行為,將不再受理其臨床急需進口藥品申請,并將其違規行為及時納入個人征信系統,依法追究相關法律責任。
第十四條 本辦法由省藥品監督管理部門負責解釋。
第十五條 本辦法自印發之日起施行。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

《化妝品生產經營監督管理辦法》已經2021年7月26日市場監管總局第12次局務會議通過,現予公布,自2022年1月1日起施行。
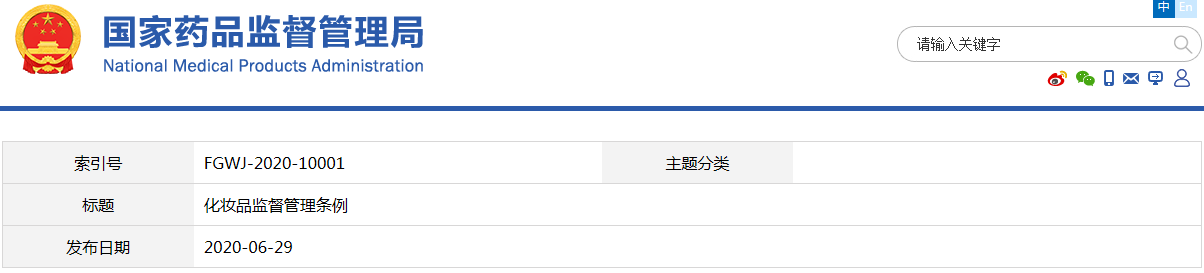
《化妝品監督管理條例》已經2020年1月3日國務院第77次常務會議通過,現予公布,自2021年1月1日起施行。

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《
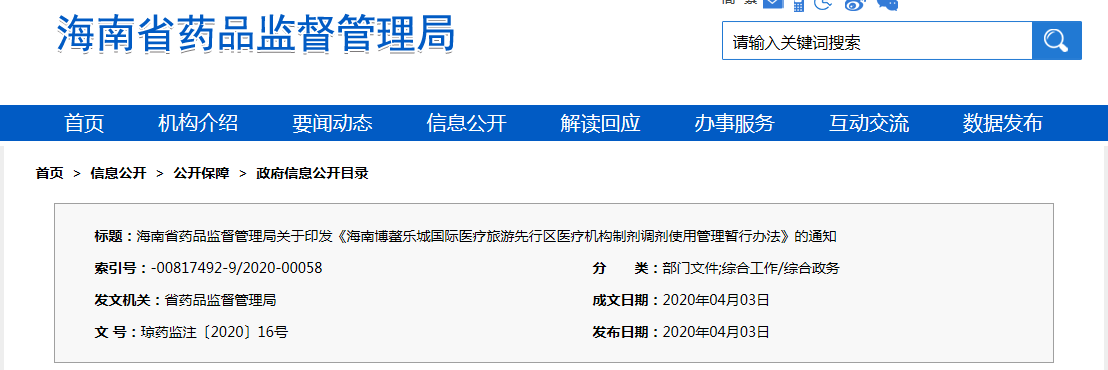
《海南博鰲樂城國際醫療旅游先行區醫療機構制劑調劑使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行。

關于發布醫療器械質量管理體系年度自查報告編寫指南的通告(2022年第13號)發布時間:2022-03-24為加強醫療器械生產監管,保障醫療器械安全有效,根據《醫

《醫療器械監督管理條例》已經2020年12月21日國務院第119次常務會議修訂通過,現予公布,自2021年6月1日起施行。

為深化藥品審評審批制度改革,鼓勵創新,進一步推動我國藥物臨床試驗規范研究和提升質量,國家藥品監督管理局會同國家衛生健康委員會組織修訂了《藥物臨床試驗質量管理規范》

附件:醫療器械監督管理條例(2025年修訂版).doc醫療器械監督管理條例(2000年1月4日中華人民共和國國務院令第276號公布 2014年2月12日國務院第

為深化醫療器械審評審批制度改革,加強醫療器械臨床試驗管理,根據《醫療器械監督管理條例》(國務院令第739號)及《醫療器械注冊與備案管理辦法》(市場監管總局令第47號)、《

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
