長江三角洲區域醫療器械注冊人制度試點工作實施方案(試行)(滬藥監械管〔2019〕112號)
為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械
來源:醫療器械注冊代辦 發布日期:2017-03-02 閱讀量:次
附件:人工耳蝸植入系統注冊技術審查指導原則(2017年第35號).doc
本指導原則是對人工耳蝸植入系統的一般要求,注冊申請人應依據具體產品的特性對注冊申報資料的內容進行充實和細化。注冊申請人還應依據具體產品的特性確定其中的具體內容是否適用,若不適用,需具體闡述其理由及相應的科學依據。
本指導原則是對注冊申請人和審查人員的指導性文件,但不包括注冊審批所涉及的行政事項,亦不作為法規強制執行,如果有能夠滿足相關法規要求的其它方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。應在遵循相關法規的前提下使用本指導原則。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的,隨著法規和標準的不斷完善,以及科學技術的不斷發展,本指導原則相關內容也將進行適時的調整。
本指導原則適用于重建重度和/或極重度感音神經性耳聾患者聽覺的人工耳蝸植入系統,包括人工耳蝸植入體和人工耳蝸聲音處理器,人工耳蝸調機裝置及調試軟件。
按照《醫療器械分類目錄》,人工耳蝸植入體的管理類別為三類,分類編碼為6846,人工耳蝸聲音處理器的管理類別為二類,分類編碼為6821,人工耳蝸調機裝置及調試軟件的管理類別為二類,分類編碼為6870。
(一)產品描述
1.作用機理:描述產品作用于人體的基本原理和預期作用。
2.工作原理:描述產品的基本工作過程。
3.系統組成及結構:
(1)給出系統產品組成及申報注冊產品組成,并應說明各部件功能。
人工耳蝸植入系統通常包括植入式組件、非植入式組件、人工耳蝸調機裝置及調試軟件、手術工具。其中植入式組件包括:接收刺激器、電極、連接器(如適用)。非植入式組件包括:聲音處理器與體佩配件、非體佩配件與可置換體佩配件、體佩與非體佩電纜。人工耳蝸調機裝置及調試軟件包括:臨床編程、臨床測定軟件、測試材料。
(2)給出系統(含臨床調試裝置,調試軟件)布置圖、系統實物圖,應包含完成預期用途的各組件及必要解釋,用方框圖表示本次注冊產品的全部組成。
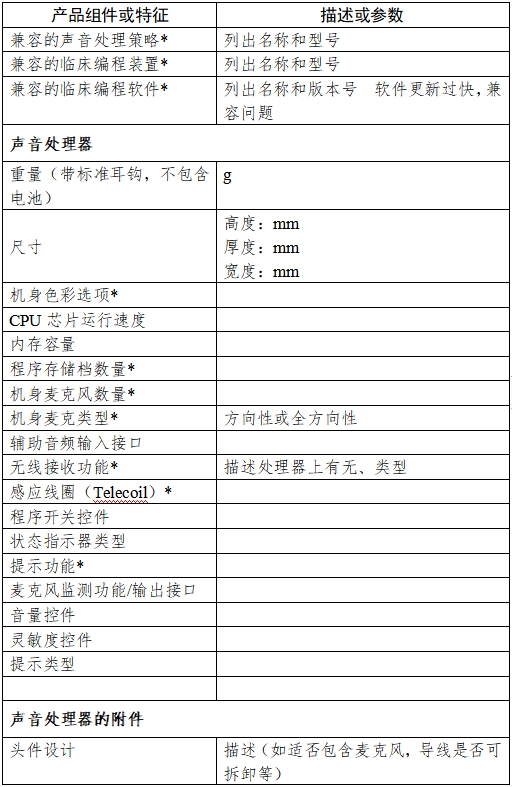
(3)兼容性:在產品信息表中(見附錄1)以表格形式給出組件和功能的兼容性能。組件和功能包括但不限于可植入組件、聲音處理器、聲音處理策略,前端信號處理功能,附件,以及臨床編程硬件和軟件。
4.系統功能概述及框圖:
應提供系統在不同模式下的電路框圖及各個單元模塊的電路框圖或流程圖,并詳述各個模塊的功能。
應提供系統在患者常規使用和臨床編程和測量模式下的系統各組件及其連接的模塊功能框圖。
應指明所有由用戶所提供的部件(如安裝有臨床編程軟件的Windows平臺計算機)。
所有可能建立的連接或無線鏈路都應被明確標明。
應明確標明前向和反向鏈路(如適用),包括患者正常使用時處理器與植入體之間的前向鏈路,和臨床編程過程中測量阻抗或電誘發復合動作電位時的反向鏈路。
所有市電主電源供電的連接都應標明。
在所提供的框圖和描述中,應當至少包含以下要素:
(1)通過麥克風進行的聲學信號轉換;
(2)輔助信號源;
(3)聲音處理器進行的模數(A/D)轉換和信號預處理;
實現信號處理策略所需的硬件組件;
(4)數模(D/A)轉換;
(5)射頻(RF)載波信號的調制和經由傳輸線圈進行的傳送;
(6)植入體線圈對傳輸信號的接收;
(7)植入體電路進行的解調和數字化;
(8)電刺激波形;
(9)刺激信號通過直流(DC)隔離電容器或其它方法,以確保零凈電荷傳輸;
(10)電流信號傳輸至電極陣列中的各個電極。
5.明確植入組件與非植入組件與人體接觸原材料和添加劑(如顏料):包括材料的化學名稱、廠家。高分子材料應提供美國化學文摘服務社為化學物質制訂的登記號(CAS號碼)和化學品安全技術說明書(MSDS);金屬材料應提供牌號,符合的標準(如適用)和材質單;對于添加劑,請提供重量百分比。
6.植入組件結構及功能的詳細描述(如申報):可植入組件為可通過手術埋植在體內的部分。
(1)接收—刺激器:描述接收線圈、封裝電路內的接收模塊和刺激器設計原理,基本功能模塊框圖;體現功能特性的結構圖(含關鍵部位正視圖,剖面圖,側視圖,拆解圖);描述外形和構造特點,圖示應包括尺寸,接觸人體材料的位置分布。在產品信息表中給出物理特性。
(2)電極系統:描述電極設計原理,結構圖(含關鍵部位正視圖,剖面圖,側視圖,拆解圖)。圖示應包括尺寸,接觸人體材料的位置分布。在產品信息表中給出電極物理特性,電極觸點的尺寸、電極陣列的長度、電極體的排布方法等。在產品信息表中,給出電極的主要規格特性。包含但不限于以下內容:
—電極形狀及其他特性(例如是否近耳蝸軸電極)。
—電極耦合配置(例如,單極、雙極或其他耦合方式;接地電極的設計;獨立電極觸點的數量)。
—植入組件在實現預期用途的正常運行期間,其電極阻抗的典型范圍,并描述正常運行和/或臨床支持狀態下測量電極阻抗的方法。
—識別或計算電極陣列和/或電極導線內短路/開路的方法。
—可植入組件正常運行期間刺激電極的電荷量和電荷密度的范圍。
(3)植入體各部件關鍵元器件的規格、來源和功能描述,如DC隔離電容、數字集成電路芯片、模擬集成電路芯片、絕緣器件等。
7.手術工具(如適用)
應列出手術中用于插入,移除,固定可植入組件的工具組件,應提供圖示,并詳細描述其用途和操作方法。
8.人工耳蝸聲音處理器及其附件的硬件描述(如申報)
包括但不限于以下組件。應提供圖示,描述外形,構造和性能特點,與外部設備的連接情況,功能,原理,在產品信息表中給出性能參數。
(1)人工耳蝸聲音處理器
應包含單獨電刺激人工耳蝸系統和聲-電聯合刺激人工耳蝸系統的聲音處理器。作為基本的運行模式,聲音處理器由電池供電,接收并處理聲音信號,然后將已處理的信號和電能傳輸至植入體。頭件線圈作為聲音處理器的固有部分,應包含在聲音處理器的描述中。應包含電-聲聯合刺激系統中聲學放大部分的組件描述。
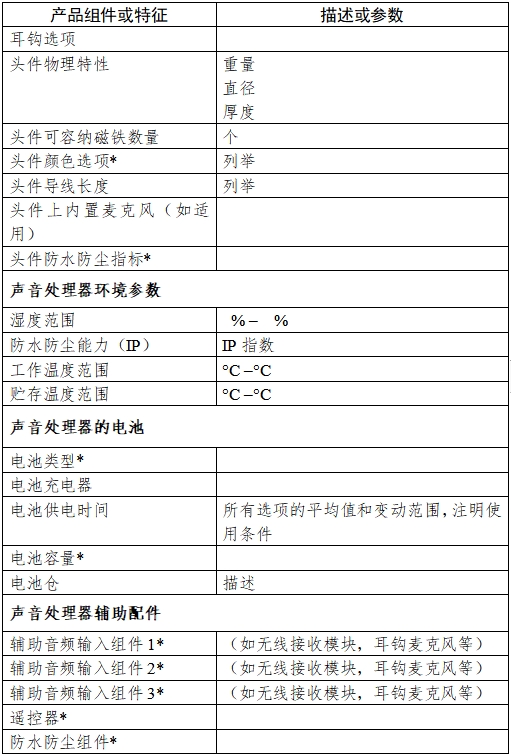
(2)人工耳蝸聲音處理器的附件:
與實現聲音處理器基本功能和擴展功能相關的附件,包括但不限于頭件導線,電池和電池充電器,電池倉、耳鉤、輔助輸入組件(例如包括直連輸入,遙感線圈,FM系統等),遙控器,麥克風監聽設備或其它測試組件,防水組件等。
(3)聲音處理器各部件關鍵元器件的規格和來源
9.聲音處理策略及硬件描述
應提供患者正常使用時系統軟件單元的詳細描述,并應提供以下相關功能框圖:
(1)高層次概況圖(模塊框圖),以展示主要的軟件單元,輸入/輸出,并描述主要的硬件元件,如數字信號處理器(DSP)以及微控制器等;
(2)系統軟件架構的層次結構圖;
(3)詳細的端對端信號通路概況框圖,以顯示從麥克風轉換(及輔助輸入)至線圈驅動信號的產生并輸送至傳輸線圈的主要處理模塊。
注冊申請人也應創建有關聲音處理策略和人工耳蝸系統配置中硬件組件的軟件實現方法的敘述性說明和概括框圖。該框圖應說明支持該器件醫療應用所需的所有相關處理組件。
系統或聲音處理的框圖應包括多個可充分描述該軟件系統的子框圖。注冊申請人應把固件組件區分為硬件或軟件,從而盡可能清晰描述整個系統。
對于每一種所提出的聲音處理策略,都應提供敘述性說明和框圖,從而詳細說明將音頻信號如何分解為單個頻帶以及基于頻帶分析的信號處理方法。敘述性說明應清楚陳述聲音處理策略的設計原理,并借助框圖描述信號處理過程。應包括關于雙模式和/或雙側刺激的特殊考慮以及使用雙模和/或雙側刺激的操作模式。
來自不同處理階段代表性信號的圖表應在框圖中描述,或者單獨呈現并引用框圖。對于音頻信號的典型樣本,應提供這些圖表,如話音,這些圖表將展現聲音處理策略及整個系統的預期設計原理。
應說明和定義框圖中描述的信號處理策略。注冊申請人應提供包括下述信息的設計考慮以及實現方法:
(1)前端信號處理和音頻信號數模轉換規格,其中包括:
—麥克風特性(麥克風的數量和機械配置、麥克風的動態范圍和本底噪聲水平、頻率響應特性、方向性特性與處理方案)
—前置放大器增益與頻率響應特性
—關于麥克風試驗的規定(若可提供)
—備選輸入信號的規范(輔助信號輸入類型、直接連接標準實施方案(依照IEC 60118-6)、FM信號源、拾音線圈功能部件(依照IEC 60118-1)
(2)其它信號輸入方法,包括數字信號流。
(3)A/D轉換器規格,包括下述內容:
—轉換器的分辨率(如8位)
—采樣率,單位:每秒樣本數
—關于預防信號混淆的規定
(4)在帶通濾波(可能發生在音頻信號A/D轉換之前或之后)之前發生的預增強或預處理操作的清單及定義,包括下述內容:
—空間音頻選擇性處理,例如聲束成形
—標有窗口類型(例如,漢寧修勻,加重平均),窗口持續時間以及其它窗口特性的信號加窗處理
—自動增益控制
—輸入動態范圍(IDR)的定義(若適用)
(5)關于音量和靈敏度控制的功能規格和實施細節(若適用),包括遙控器功能部件
(6)其它預處理過程,包括語音加重增強,聲音分類和/或噪音抑制策略等。
(7)對每個聲音處理策略的頻譜分析和相關的處理操作,例如下述內容:
—將音頻信號經頻譜分析分解為單個頻帶的處理和規格,如一組帶通濾波器,快速傅里葉變換(FFT),小波變換
—單個頻帶的數量(例如,帶通濾波器的數量和/或用于基于FFT的頻譜分析的連續FFT bin的分組數量)
—單個頻帶頻率調諧的尖銳度(例如,帶通濾波器的質量因子[Q因子]和/或分組在一個頻帶中的連續FFT bin的數量)
—包絡計算和提取的定義和/或來自單個頻帶的精細結構信息
—用于將頻帶包絡和/或精細結構信息轉換為傳輸至各個電極的電流的映射函數的定義
(8)數據位編碼方式,例如“0”和“1”的PWM編碼,用圖表方式給出
(9)數據幀的編碼方式,例如刺激幅度、脈沖寬度、刺激電極的規定方法。如有多種數據幀格式,應分別說明各格式的用途,特點,編碼方式。用圖形表示各數據幀的組成方式
(10)數據幀的同步方式
(11)如果植入體的時鐘信號是由體外信號提供,說明時鐘信號的頻率,提取方法,觸發沿
(12)數字信號的射頻調制方法,用圖形表示射頻調制后的各數字信號模式,射頻信號中心頻率和范圍,射頻信號幅度范圍,射頻信號傳輸距離范圍
10.刺激方法和安全刺激的預防措施:
(1)應描述人工耳蝸器件系統配置安全運行的電刺激策略,電極以及電極耦合方式,同時提供圖表說明臨床應用所需的所有相關操作模式。
(2)應描述該系統所采用的刺激波形,包括脈沖速率的特征,所刺激的電極數量等。
(3)應提供刺激波形發生電路的功能描述,包括其電氣特性(例如,運行模式,刺激輸出范圍,容限電壓,最低和最高刺激參數)。
(4)應詳細說明植入體刺激電極的電荷恢復方法,包括電容耦合,放電電阻器,電壓取樣和/或內部刺激接地間隔等。
11.列出含有無線功能的系統組件,并對系統的無線運行方式進行描述。應對所有具備無線接口的器件進行描述。人工耳蝸聲音處理器和植入接收-刺激器之間的近場電感鏈路是系統功能的組成部分,因此應進行充分描述。在系統組件框圖中應通過名稱對所有無線鏈路進行標識,對每個鏈路的描述應包括下述內容:
(1)器件功能
(2)無線電發射設備型號核準檢驗報告或無線電發射設備型號核準證書
(3)無線電頻率
(4)調制方式
(5)數據速率
(6)帶寬
(7)輸出功率
(8)比吸收率SAR(若適用)
(9)操作范圍
(10)安全保護
(11)關于數據完整性的規定
(12)無線共存
注冊申請人應描述下述信息:
—提供輸入信號的無線接口(設計目標;雙向或單向;頻率和調制方式;實際使用中的室內范圍,以極坐標圖描述;以及適用的標準)。
—連接植入體的RF鏈路(皮瓣厚度,可兼容的植入體以及聲音處理器)。
12.臨床編程支持組件
應采用足夠的技術細節對臨床調機軟件進行概述,臨床調機軟件至少應包括下述信息(若適用):
(1)運行臨床調機軟件的計算機的硬件和軟件要求(如計算機平臺)。對于可能用于臨床調機的任何其它計算機以及任何互聯網和/或關于計算機的無線連接要求也應提供這些信息。
(2)用于每個聲音處理策略和/或植入器件的臨床單位的定義,按照物理參數分類,分別為電流(μA),電荷(μC),時間(μS),包括用于將臨床單位轉換為物理單位以及將物理單位轉換為臨床單位的公式。
(3)按照許可電流和電荷量(物理單位)確定參數空間的上限和下限,假定恒流輸出電壓以及所有其它參數(皮瓣厚度)都不是限制因素。
(4)以技術細節描述阻抗和誘發復合動作電位測量的規格,包括:
—可實現的刺激波形(例如,雙相脈沖)。
—電流水平(單位:μA),脈沖寬度(單位:μS)以及電荷量/脈沖(單位:μC)。
—測量時間的標識,例如,緊隨連接至配套計算機和打開軟件之后。
—阻抗值測量時采取的刺激電流脈沖數量,以及所采用刺激脈沖的正相還是負相。
—測量(如阻抗和神經反應測量)的準確度和精度。
(5)調機軟件中內置自動識別和標記開路或短路電極功能所采用的定義。
(6)在軟件和/或處理策略中用來確定是否使用某個電極的標準(例如,阻抗和容限電壓標準)。
(7)關于數據顯示方式的定義,包括用于范圍內或超出范圍阻抗的彩色標識帶的定義;提示到達電壓容限值的方式。
(8)所有可實現的刺激模式。
(9)默認設置(如常見的接地模式)以及所有可用的臨床可調節設置的識別。
13.遙控器的功能和特性,注冊申請人應說明以下信息:
(1)可同時遙控植入系統的數量
(2)控制方式(例如,鍵盤、按鈕、觸摸屏)及其功能(即聲音處理器上能被改變的參數)
(3)指示器類型(例如,發光二極管,顯示屏)與所提供的信息。
(4)遙控器是否有按鍵鎖,若適用,提供按鍵鎖的描述
(5)遙控設備的電氣性能描述
—通信技術(例如,紅外線、超聲波、電磁波等)
—數據協議(說明協議標準,除非使用專有協議)
—通信頻率
—為遙控器與所控制的聲音處理器之間進行鍵編碼而采取的措施
—遙控器與聲音處理器之間的遙控范圍(以厘米為單位)
14.人工耳蝸系統的輔助功能描述及設計說明,包括基本功能結構描述和框圖。
(1)阻抗測量
(2)神經反應遙測功能
(3)電-聲聯合刺激(EAS)模式中的聲學組件
(4)核磁(MRI)兼容功能,應說明:
—安全的磁共振磁場強度
—各磁場強度下是否需要取出內磁鐵
—各磁場強度下的預防措施(如植入體部位包扎繃帶)
—各磁場強度下的植入體受力、溫升、非預期電流輸出、損壞
(5)說明書宣稱的產品特點和具備創新性的其他功能的設計說明
(二)規格型號
對于申報的多種規格型號的產品,應當:
1.列出產品型號,描述各型號主要功能模塊及其組成部件,提供圖示說明。
2.描述并列出不同型號之間的差別。
(三)包裝說明
明確產品包裝上的信息,產品一起銷售的配件包裝情況。應該描述滅菌方法,提供滅菌包裝的驗證報告。提供在宣稱的有效期內及運輸條件下,保持包裝完整性的依據。
(四)適用范圍和禁忌癥
適用范圍:應當明確產品的適用范圍及其配套使用的器械,同時明確適用的人群和使用環境。
禁忌癥:應當明確產品不適用的一些疾病或特殊人群。
適用范圍舉例:
人工耳蝸植入體:用于重建重度和/或極重度感音神經性耳聾患者聽覺。用于成人或1歲以上兒童。
人工耳蝸聲音處理器:對聲音進行數字處理后經由人工耳蝸植入體將電刺激傳遞至聽覺神經以恢復聽覺,或通過聲電聯合刺激聽覺通路,可用聲學放大補償殘余聽力。
(五)參考的同類產品或前代產品的情況(如有)
1.應提供本企業已經上市同類產品清單,明確產品型號、注冊證號、批準日期、產品組成、適用范圍。
2.按照臨床評價指導原則附件3及本指南產品規格表,提供同品種產品信息的參數對比表,并識別出申報產品的新技術、新功能、新特征。
(一)可植入組件性能研究
1.可植入組件可靠性研究
注冊申請人應提供硬件可靠性評價材料,應能從設計分析、過程控制和試驗驗證等方面說明各主要部件及產品的可靠性。應保證至少10年的預期使用壽命。
(1)接收線圈的可靠性評價
應包括線圈的彎曲應力,抗折能力。接收線圈的連接可靠性。
(2)電極的可靠性評價
對電極的可靠性分析可從垂落試驗、彎曲試驗、拉伸試驗來判斷。
(3)密封殼體的可靠性評價
對密封殼體的可靠性應從抗撞擊度和密封性能考慮。對于封裝工藝的可靠性評價,注冊申請人可以根據擬申報產品實際采用的零部件、密封結構、材料(含密封絕緣材料、連接材料)和封裝工藝,從設計分析、過程控制和可靠性試驗結果等方面說明該封裝工藝的可靠性。
注冊申請人應當提供可植入器件內部在預期使用壽命中可接受的潮氣含量的設計分析和驗證報告。可以參考美國標準AAMI/CDV-2 CI86《人工耳蝸植入系統安全、性能和可靠性》第20.7節進行。
(4)刺激器的可靠性評價
對刺激器的可靠性評價主要考慮電路的可靠性。為了提高預測的可信度,電路模塊中使用的主要零部件都應有供應商提供的可靠性數據,對于少數無法從供應商獲取可靠性數據的零部件,可由人工耳蝸注冊申請人通過加速壽命試驗取得數據或引用來自文獻的試驗結果和/或數據。
老化測試可以參考AAMI/CDV-2 CI86第6.8節和MIL-STD-883G Method 1005.9標準提供。
穩態壽命試驗的目的是為了證明設備在一個較長的時間段內的特定條件下的質量和可靠性。額定工作條件下進行的壽命試驗應進行足夠長的試驗周期,以保證結果不具有早期故障的特點且未出現故障率隨時間有顯著變化的情況。有效的結果在較短的時間內或在較低的應力需要加速試驗,條件或足夠大的樣本量,以提供一個合理的檢測樣品中的故障的概率。
壽命試驗在125℃下帶電工作至少1000小時,除非另有規定。
如果人工耳蝸廠家所使用某些部件是外購的,可以引用部件供應商的有關可靠性評價材料作為該部件可靠性評價的依據。
(5)人工耳蝸整機可靠性的評價
注冊申請人對人工耳蝸整機(包括組件,如果其組件也適用)進行可靠性試驗,試驗及分析應該能證明人工耳蝸注冊申請人聲稱的預期使用壽命和人工耳蝸的故障率。對試驗結果和/或文獻進行的數據分析為該設備提供預測的故障率。提供使用高溫水浴法來驗證人工耳蝸整機的硬件可靠性的報告或等同的報告。應參考美國AAMI/CDV-2 CI86標準提供潮氣量測試報告。
2.根據ISO/TS 10974的標準要求,應建立在核磁共振下的模型并提供包含以下項目的檢測報告:磁感應扭矩、磁感應位移力、梯度感應的振動、射頻感應加熱、梯度感應加熱、非故意的器件輸出、植入體磁鐵弱化、植入體功能性喪失、偽影。應同時提交檢測機構資質證明文件。
3.移除和重新植入兼容性的設計保證
4.主動發射無線信號的植入體應提供無線電發射設備型號核準檢驗報告或無線電發射設備核準證書,證明射頻技術指標符合《微功率(短距離)無線電設備的技術要求》。
5.系統測試規范與報告
(二)非植入組件的性能研究
1.聲音處理器的機械性能
注冊申請人應提供針對下列機械性能要求的設計考慮,以及實現方法:
(1)聲音處理器的防水防塵(IP等級)設計
(2)麥克風的防水防塵(IP等級)設計
(3)聲音處理器各連接件的連接次數壽命設計
(4)發射線圈插頭插座的拔插壽命設計
(5)線圈導線的折彎壽命設計
(6)線圈導線的長度規格和設計考慮
2.聲音處理器的電氣性能
注冊申請人應提供針對下列電氣性能要求的設計考慮,以及實現方法:
(1)無線電設備應提供無線電發射設備型號核準檢驗報告或無線電發射設備核準證書,證明射頻技術指標符合《微功率(短距離)無線電設備的技術要求》。
(2)電池倉種類是否能充電,充放電次數,和各種電池的平均使用時間驗證報告。
注冊申請人應提供能夠證明電池安全的第三方認證證書,或提供滿足以下標準的檢驗報告。
GB 31241-2014《便攜式電子產品鋰離子電池盒電池組安全要求》標準
GB 8897.4--2008原電池—第4部分:鋰電池的安全要求
IEC 62281,運輸過程中主要電池和次要鋰電池及蓄電池組的安全
IEC 62133,含堿性或其它非酸性電解液的蓄電池和蓄電池組—便攜式密封蓄電池和蓄電池組的安全要求
聯合國(2009),關于危險品運輸的建議,手冊及試驗標準,第5次修訂版。
(3)人體模式下靜電防護功能:包括接觸放電和非接觸放電條件下的靜電防護指標
(4)聲音處理器各部件關鍵元器件的規格和來源
(5)其他聲音預處理方法,包括語音增強、聲音分類,和/或噪聲抑制策略
(6)系統測試規范與報告
(7)人工耳蝸系統功耗的設計方法、實現方案和測試驗證結果,包括植入體、聲音處理器及能量傳輸效率。是否有射頻發射功率調節功能,如有說明調節方法和調節范圍。
(三)生物相容性評價研究
生物相容性評價應依照GB/T 16886系列標準進行。生物相容性評價應當對經滅菌后最終產品或代表性樣品進行。
1.植入體生物學試驗至少應包括:
(1)細胞毒性試驗
(2)皮內刺激試驗
(3)致敏試驗
(4)全身急性毒性試驗
(5)全身亞慢性毒性試驗
(6)遺傳毒性試驗
(7)植入試驗。
2.非植入組件生物學試驗應包括:
(1)細胞毒性試驗
(2)皮內刺激試驗
(3)致敏試驗
所有試驗都必須在符合良好的實驗室規范的實驗室進行。
(四)滅菌工藝的研究
無菌部件應提供滅菌的方法,以及應達到的滅菌水平,同時提供滅菌驗證報告。
(五)有效期和包裝研究
無菌部件應考慮滅菌有效期。包裝可分為運輸包裝和無菌包裝,參考GB 16174.1-2015、ISO 14708-7:2013的內容。無菌包裝應符合GB/T 19633《最終滅菌的醫療器械的包裝》的要求,同時進行滅菌包裝并對包裝有效性進行確認。提供包裝老化的測試報告。
在宣稱的有效期內以及運輸儲存條件下,保持包裝完整性的依據。
(六)動物研究
全新的生產企業,全新的植入體必須進行動物研究來評價其產品對神經刺激的有效性及產品的安全性。
全新的植入體是指現有安全性和療效數據未涵蓋的植入體,如全新原理,全新療法,變更療法,全新材料等現有安全性和療效數據不支持的植入體。
已有人工耳蝸產品上市的生產企業,如有充分的證據說明產品更新部分的安全性、有效性,可免于動物實驗,并提供支持性資料。
進行動物研究的機構,應為具有動物研究資質的單位,應能夠提供相關部門頒發的動物試驗資格證明文件。
(七)軟件研究
如有軟件,按照《醫療器械軟件注冊技術審查指導原則》(2015年第50號)提交資料,如為采用集成電路設計的植入體芯片,參照《醫療器械軟件注冊技術審查指導原則》提交資料。
(一)應明確產品的生產工藝過程,可采用流程圖的形式,并標明關鍵工藝、特殊工藝、外包工藝,并說明其過程控制點。
(二)有多個研制、生產場地,應當概述每個研制、生產場地的實際情況。
臨床評價的具體要求另作規定。臨床試驗的具體要求可參考《人工耳蝸臨床試驗指導原則》(2017年第3號)。
注冊申請人應在產品的研發階段,對產品的有關可能的危害及產生的風險進行估計和評價,并有針對性地實施了降低風險的技術和管理方面的措施,對所有剩余風險進行評價,達到可接受的水平。
(一)對于各種可能的危險,應建立有關危險控制和傷害可能性評估、設計分析和試驗研究的文件。注冊申請人應參照YY/T 0316-2008建立人工耳蝸風險管理文檔,風險管理文檔應包括:
1.風險管理可接受度準則
2.風險管理計劃
3.風險管理報告
(二)風險管理活動要求應貫穿于人工耳蝸的整個生命周期。因此,并非只有在產品上市前需要考慮風險管理,對于上市后的產品,仍然需要進行生產和生產后的風險管理,注冊申請人至少要建立以下程序文件來保證風險管理的持續性:
1.不合格品控制程序
2.設計或者工程變更控制程序
3.市場監督和反饋處理程序,以便從不同來源收集信息如使用者、服務人員、培訓人員、事故報告和顧客反饋
4.糾正和預防措施程序
產品上市后注冊申請人對產品風險管理程序及內容進行的任何更改都需要形成文件。
(三)植入式人工耳蝸系統可能風險包括并不限于:意外輸出:過度刺激,無刺激或間斷刺激等;直流漏電流超出限值;超出電荷密度和每相電荷限值;其他醫療措施可能對人工耳蝸系統及使用者產生的損害(如消磁,升溫,變熱,電路故障,移位或器械損壞等);與遙測相關的故障(如遙測結果錯誤);與人工耳蝸手術相關的風險;與聲音處理器部件有關的不良生物學反應(如皮膚刺激、過敏等),過小部件的幼兒吞咽;電池處置不當導致的中毒、污染及電池缺陷等
(四)植入式人工耳蝸系統潛在危險包括并不限于:
1.能量危險:包括過高的漏電流會對患者產生危險;引起人體組織過熱或導致燒傷;機械力;電離輻射;非電離輻射;電磁場;磁場(如MRI)
2.生物學危險:包括生物負荷、生物污染、生物不兼容、異常輸出(物質/能量)、毒性反應、(交叉)感染、降解。
3.環境危險:包括電磁干擾、與其他器械不兼容、機械損傷事故、由于廢棄物和/或丟棄的器械導致的污染。
4.與使用裝置相關的危險:包括錯誤操作、錯誤的數據傳輸、標簽不足或不正確、手術技術說明書內容不全或過于繁復、警告信息不全或不恰當、培訓(材料可用性、要求等)、與成功完成預定的醫療手術所必要的其它裝置、產品等不兼容。
5.由于裝置維護和老化引起的危險:包括應用植入體的指征不符合、維護說明書缺失或內容不全、器械及包裝完整性喪失(包括污染和/或損壞)、不適當的再次使用、與手術相關的風險、器械提前失效、喪失氣密性等。
產品技術要求應按照《醫療器械產品技術要求編寫指導原則》(2014年第9號)的規定編制。人工耳蝸植入體及人工耳蝸聲音處理器的產品技術要求示例見附錄2及附錄3。人工耳蝸調機設備及調機軟件中軟件部分可參考軟件指導原則技術要求示例提供。
說明書、標簽應符合《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)和GB 16174.1-2015、ISO 14708.7-2013的要求。應特別注意:
(一)應當提供申報范圍內所有型號的說明書,應覆蓋所申請的所有組成部分。
(二)應當提供產品所有說明書。如技術說明書、使用說明書、安裝維修說明書,安全手冊,醫生手冊,患者手冊單獨成冊,應全部提供并應提供說明書的構成說明。
(三)說明書摘要:按照《醫療器械說明書和標簽管理規定》第10條、第11條給出說明書必有項目的摘要,并承諾說明書摘要中內容與說明書中內容一致,說明書已符合了相關法律法規的要求及技術要求中對說明書及標簽的要求。
(四)說明書及標簽均應當明確MRI的適用情況,如:
1.MR安全—在所有MR環境中都不產生已知危害的物體。
2.MR特定條件安全—在特定MR環境和特定工作條件下不產生已知危害的物體。磁場中的特定MR環境包括磁場強度、磁場空間梯度、磁場時間變化率(d B /d t)、射頻(RF)場以及特定吸收率(SAR),除此之外,還可能包括物體的特殊構型。
3.MR危險—在所有MR環境中均構成危險的物體。
注冊單元的劃分應根據產品的適用范圍、性能指標、結構組成進行綜合判定。考慮產品性能規格或設計規格、軟件、電路、部件、材料、運行原理或實體布局等。
(一)人工耳蝸植入系統區分人工耳蝸植入體、人工耳蝸聲音處理器、人工耳蝸調機設備及軟件、手術工具四個注冊單元進行注冊。如果手術工具與人工耳蝸植入體在同一無菌包裝內,應作為人工耳蝸植入體附件一同進行注冊。
(二)工作原理不同,如單通道與多通道的人工耳蝸植入體應劃分為不同的注冊單元。
(三)核心材料不同,如刺激器為鈦殼的與陶瓷的,材料可在核磁下使用的與非核磁下使用的,應劃分為不同的注冊單元。
(四)功能參數、主要元器件、制造工藝發生重大變更,如刺激器不同的人工耳蝸植入體,密封工藝不同的人工耳蝸植入體等,應劃分為不同的注冊單元。
(五)電極結構區分較大的,(如直電極、彎電極),應劃分為不同的注冊單元。
(六)刺激器通道數目不同導致的電極陣列、電極排布不同,應劃分為不同的注冊單元。
(七)適用范圍不同,如具有電聲聯合刺激功能的人工耳蝸聲音處理器與不具有電聲聯合刺激功能的人工耳蝸聲音處理器,應劃分為不同的注冊單元。
(一)產品無變化聲明
產品無變化聲明應明確產品沒有發生注冊證和產品技術要求載明事項的變化,如:
1.器械適用范圍的增加或變更。
2.使用不同工藝對產品進行生產、加工、滅菌或包裝。
3.可能影響器械安全性和有效性的關鍵部件或關鍵材料的供應商發生變更。
4.可能影響器械安全性和有效性的性能規格或設計規格、軟件、電路、部件、材料、運行原理或實體布局的變更。
5.器械有效期的延長,所依據的數據來源于尚未被監管部門批準的穩定性/無菌性測試方案。
(二)年度器械故障報告
注冊證有效期內產品分析報告應包含年度器械故障報告。
器械故障定義為,器械被取出且不合格,導致臨床利益損失;器械保持在原位且不合格,導致臨床利益損失。
申請人應向主管部門報告全部機器故障(不包括開箱壞損和非植入部件的失效),應區分產品型號,提供年度累計存活率,并在計算累計存活率時包括這些故障。
申請人的器械故障報告應說明數據來源和樣品大小。不存在特例,必須指明采集數據的時間。
累計存活率報告應包括關于特定器械的完整歷史數據,說明任何技術改造(可以從0開始將其整合到歷史數據中)。
報告后續的器械改造數據時,應提供原產品的完整數據集。
如果外殼和/或電極和/或電子裝置發生變化并貼上了自己的標志,則將其歸為一種新器械。
累計存活率應該分別針對成人和兒童,并取95%(如果不足1000,則為80%或90%)的置信區間。
器械存活時間從術中傷口縫合開始算。
應對器械故障原因進行分類統計,并提供原因分析報告及處理結果,必要時提供整改措施。
(三)產品分析報告中產品臨床應用情況中應提供中國植入者基本信息及產品編號。
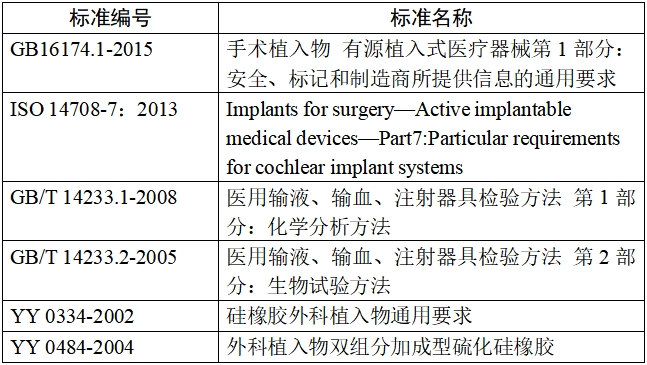
(一)如適用,人工耳蝸植入體應符合的標準包括并不限于:
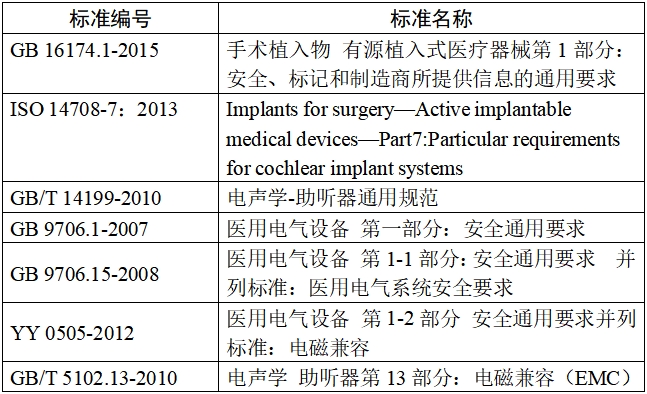
(二)人工耳蝸聲音處理器應符合的標準(如適用)包括并不限于
ISO 14708-7:2013 標準中下列術語和定義適用于本指導原則。
(一)人工耳蝸植入系統
有源植入式醫療器械,由植入和非植入部分組成,預期通過電刺激耳蝸來治療聽力障礙。
(二)植入體
人工耳蝸植入系統的植入部分。
(三)聲音處理器
植入系統的體外部分。包括但不限于聲音處理器(言語處理器),麥克風,線圈或電源。
(四)刺激器
植入系統的植入部分,包括用于產生電刺激的電子電路。
(五)電極觸點
設計來與身體組織或體液形成連接的導電部分。
(六)電極陣列
包含多于一個電極接觸的導線遠端部分。
(七)參考電極
設計為電刺激電流回路的導電部分。
(八)電極導線
從刺激器引出的電極部分,不包括電極陣列部分。
(九)磁體
產生體外磁通量的部件。
(十)無線共存
一個無線系統在給定共享環境下執行任務的能力,在給定共享環境中,其他系統有執行各自任務的能力并可能采用相同或不相同的規則集。
(十一)數據完整性
確保傳輸文件不會在未經察知的情況下被刪除、修改、復制或偽造。
(一)《醫療器械注冊管理辦法》(國家食品藥品監督管理總局令第4號)
(二)《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)
(三)國家食品藥品監督管理總局關于發布醫療器械產品技術要求編寫指導原則的通告(國家食品藥品監督管理總局通告2014年第9號)
(四)國家食品藥品監督管理總局關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告(國家食品藥品監督管理總局公告2014年第43號)?
(五)醫療器械臨床評價技術指導原則(國家食品藥品監督管理總局通告2015年第14號)
(六)《無源植入性醫療器械貨架壽命申報資料指導原則》(食藥監辦械函〔2011〕116號)
(七)無源植入性醫療器械產品注冊申報資料指導原則(食藥監辦械函〔2009〕519號)
(八)植入式心臟起搏器注冊技術審查指導原則(2016年修訂版)(國家食品藥品監督管理總局通告2016年第21號)
(九)醫療器械軟件注冊技術審查指導原則(國家食品藥品監督管理總局通告2015年第50號)
(十)衛生部《人工耳蝸臨床技術操作規范》(衛醫發〔2006〕473號)
(十一)人工耳蝸植入工作指南 (2013) 中華耳鼻喉頭頸外科雜志2014年2月2014,Vol.49, No.2
(十二)Guidance for Industry and FDA Staff Implantable Middle Ear Hearing Device.August1,2003
(十三)YY/T 0987.1-2016《外科植入物磁共振兼容性 第1部分:安全標記》
(十四)YY/T 0987.2-2016《外科植入物磁共振兼容性 第2部分:磁致位移力試驗方法》
(十五)YY/T 0987.3-2016《外科植入物磁共振兼容性 第3部分:圖像偽影評價方法》
(十六)YY/T 0987.5-2016《外科植入物磁共振兼容性 第5部分:磁致扭矩試驗方法》
(十七)ISO/TS 10974《Assessment of the satety of magnetic resonance imaging for patients with an active implantable medical device》
(十八)GB 16174.1-2015《手術植入物 有源植入式醫療器械第1部分:安全、標記和制造商所提供信息的通用要求》
(十九)Guidance for Industry and FDA Staff Establishing Safety and Compatibility of Passive Implants in the Magnetic Resonance (MR) Environment,December 11, 2014
(二十)ISO 14708-7:2013 《Implants for surgery-Active implantable medical devices-Part7: Particular requirements for cochlear implant systems》
(二十一)AMI/CI186《Cochlear Implant Systems Safety, Performance and Reliability》
(二十二)ISO 5841-2:2014 Implants for surgery-Cardiac pacemakers-Part 2: Reporting of clinical performance of populations of pulse generators or leads
(二十三) FDA Draft Guidance for General Considerations for Animal 2 Studies for Medical Devices (October 14, 2015)
(二十四)FDA Guidance for Radio Frequency Wireless Technology in Medical Devices (August 14, 2013)
起草單位:國家食品藥品監督管理總局醫療器械技術審評中心
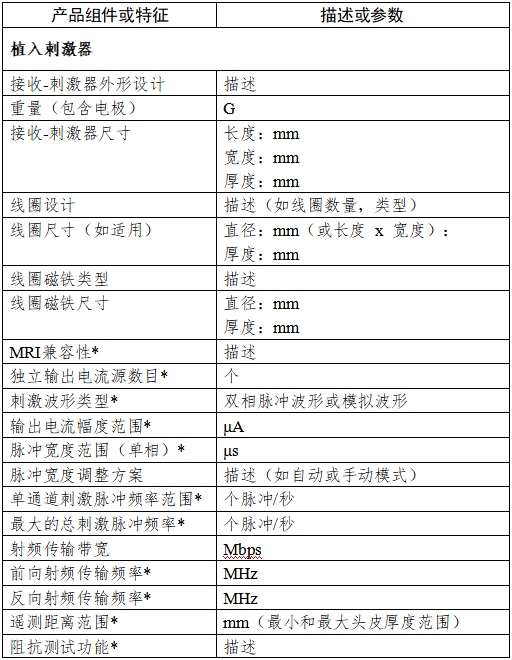
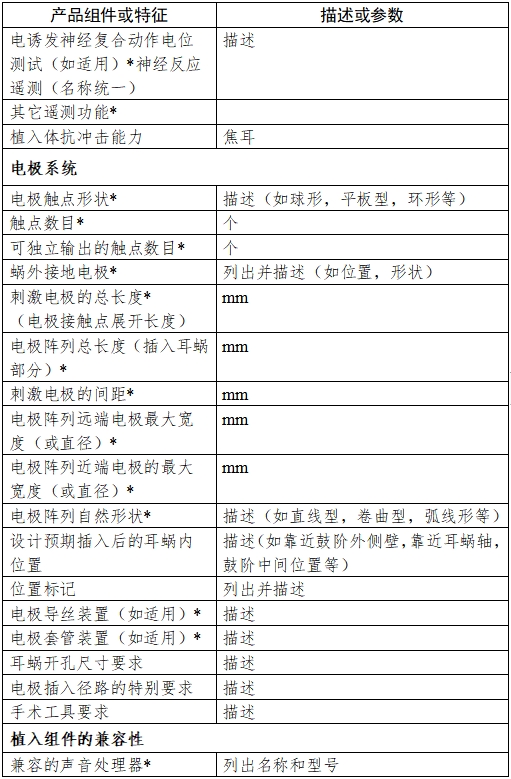
附錄:1.產品信息表
2.人工耳蝸植入體產品技術要求模板
3.人工耳蝸聲音處理器技術要求模板
附錄1
注:產品信息表中帶*號的項目應在技術要求中明確。


附錄2
醫療器械產品技術要求編號:
人工耳蝸植入體產品技術要求
1.1產品型號
1.2產品型號/規格劃分表
應提供不同型號產品之間的差異,可以表格形式列出。
1.3產品圖示及材料
1.3.1產品各組成部件結構圖,應能體現功能特性,含關鍵部位的正視圖、側視圖、剖面圖、拆解圖及必要解釋,并結合圖示描述內部結構的材料及接觸人體組織的材料列表,明確部件名稱、型號、材料名稱、化學名稱及牌號。
1.3.2植入體封裝尺寸圖及電極陣列尺寸圖
1.4軟件名稱和版本命名規則
1.4.1軟件名稱
1.4.2軟件發布版本
1.4.3軟件版本命名規則
明確軟件完整版本的全部字段及字段含義。
1.5滅菌方法
1.6滅菌有效期
2.1植入器件的物理特性
2.1.1植入體重量和尺寸
參考產品信息表提供植入體封裝和線圈重量和尺寸,并標明誤差范圍:
2.1.2電極陣列尺寸
參考產品信息表提供電極陣列尺寸,并標明測量誤差。
2.2生物學要求
2.2.1無菌
植入體應符合無菌要求。
2.2.2細菌內毒素:應小于20EU/件。
2.2.3 熱原試驗:應無熱原反應。
2.2.4 人工耳蝸植入體的硅橡膠材料化學性能
2.2.4.1干燥失重
質量不少于1.0g的植入物樣品200℃加熱4小時后,植入物樣品失重應不超過2.0%。
2.2.4.2微量元素
植入物微量金屬元素含量應不超過以下限量:
鉛(Pb)、鎘(Cd)、砷(As)的最大限量為5mg/kg,鉻(Cr)、鐵(Fe)的最大限量為10mg/kg。
2.2.4.3 蒸發殘渣
植入物樣品蒸餾水浸提液的樣品質量分數應不大于0.01;正己烷浸提液樣品質量分數應不大于3.0。
2.2.4.4酸堿度
植入物樣品液與空白液PH值之差不應大于1.5。
2.2.4.5 還原物質
樣品液與空白液消耗高錳酸鉀溶液(濃度為0.002mol/L)體積之差應不超過3.0mL。
2.2.4.6紫外吸光度
在220nm—340nm波長范圍吸收值不超過0.4。
2.2.4.7 重金屬
重金屬含量不超過1mg/L。
2.2.5金屬件材料化學成分
金屬件化學成分應符合相應標準中相應牌號的規定。
2.2.6環氧乙烷殘留量
環氧乙烷殘留量應不大于10ug/g。
2.3輸出信號的測量
2.3.1刺激脈沖幅度
應提供刺激脈沖幅度的范圍和誤差標準。
2.3.2刺激脈沖寬度
應提供刺激脈沖寬度的范圍和誤差標準。
2.3.3單個通道刺激脈沖頻率
應提供單個通道刺激脈沖頻率的范圍和誤差標準。
2.3.4最大總刺激脈沖頻率
應提供最大總刺激脈沖頻率的范圍和誤差標準。
2.4阻抗測量精度
應提供阻抗測量精度,應以百分比表示。
2.5射頻傳輸頻率(植入體線圈共振頻率)
應提供射頻傳輸頻率。
2.6射頻傳輸的最大距離
應提供射頻傳輸的最大距離。
2.7神經反應遙測功能
2.7.1遙測用刺激脈沖寬度
2.7.2遙測用刺激脈沖最大幅度
2.7.3遙測射頻頻率
2.8手術工具性能(如適用)
應根據配置的手術工具和固定器件的具體情況制定相應要求,如插入管與插入工具應接合牢固、耐腐蝕、外觀、承受的拉力,材料和滅菌方法等等。
2.8.1外觀
所有手術工具的外觀應清潔,無顆粒和異物,表面不應有毛邊、毛刺、缺損、裂紋等缺陷。
2.8.2直接接觸人體的材料
不銹鋼材料應符合GB/T 20878-2007標準中相關牌號的要求。
2.8.3耐腐蝕性
與人體接觸部件應有良好的耐腐蝕性,應符合YY/T 0149-2006中5.4b級的規定。
2.8.4無菌
如適用,手術工具應符合無菌要求。
2.9附件的技術要求
2.10說明書聲稱的其他功能
2.11產品應符合GB16174.1-2015標準的要求。
2.12產品應符合ISO14708-7:2013標準的要求。
3.1植入器件的物理特性
3.1.1植入體重量和尺寸
依據注冊申請人提供的方法進行檢驗。
3.1.2電極陣列尺寸
依據注冊申請人提供的方法進行檢驗。
3.2生物學要求
3.2.1無菌
依據GB/T 14233.2-2005的方法進行檢驗。
3.2.2 細菌內毒素
依據GB/T 14233.2-2005的方法進行檢驗。
3.2.3 熱原試驗
依據GB/T 14233.2-2005的方法進行檢驗。
3.2.4化學試驗
依據材料特性選擇YY0334-2002或YY0484-2004或GB/T14233.1-2008的方法進行檢驗。
3.2.5金屬件化學成分
依據金屬件材料選擇適用標準進行檢驗。
3.2.6環氧乙烷殘留量
依據GB/T 14233.1-2008的方法進行檢驗。
3.3輸出信號的測量
3.3.1刺激脈沖幅度
依據ISO 14708-7:2013的方法進行檢驗。
3.3.2刺激脈沖寬度
依據ISO 14708-7:2013的方法進行檢驗。
3.3.3單個通道刺激脈沖頻率
依據注冊申請人提供的方法進行檢驗,結果應符合相應的要求。
3.3.4最大總刺激脈沖頻率
依據注冊申請人提供的方法進行檢驗,結果應符合相應的要求。
3.4阻抗測量精度
依據ISO 14708-7:2013的方法進行檢驗。
3.5射頻傳輸頻率(植入體線圈共振頻率)
檢查有資質的第三方出具的檢測報告。
3.6射頻傳輸的最大距離
依據注冊申請人提供的方法進行檢驗。
3.7神經反應遙測功能
依據注冊申請人提供的方法進行檢驗。
3.7.1遙測用刺激脈沖寬度
依據注冊申請人提供的方法進行檢驗。
3.7.2遙測用刺激脈沖最大幅度
依據注冊申請人提供的方法進行檢驗。
3.7.3遙測射頻頻率
依據注冊申請人提供的方法進行檢驗。
3.8手術工具性能
3.8.1外觀
依據注冊申請人提供的方法進行檢驗。
3.8.2直接接觸人體的材料
依據GB/T 20878-2007的方法進行檢驗。
3.8.3耐腐蝕性
依據YY/T 0149-2006中5.4b級的規定進行檢驗。
3.9附件的技術要求
依據注冊申請人提供的方法進行檢驗。
3.10說明書聲稱的其他功能
依據注冊申請人提供的方法進行檢驗。
3.11按照GB 16174.1-2015的方法進行檢驗。
3.12按照ISO 14708-7:2013的方法進行檢驗。
附錄3
醫療器械產品技術要求編號:
人工耳蝸聲音處理器技術要求
1.1產品型號/規格
1.2產品型號/規格劃分表
參考產品信息表列出聲音處理器,主要附件和輔助器件主要物理特性和功能的區別。
1.3軟件名稱和版本命名規則
1.3.1軟件名稱
1.3.2軟件發布版本
1.3.3軟件版本命名規則
明確軟件完整版本的全部字段及字段含義。
1.4聲音處理策略
1.5產品圖示
產品各組成部件結構圖,應能體現功能特性,含關鍵部位的正視圖、側視圖、剖面圖及必要解釋,并結合圖描述與人體接觸的材料,明確材料名稱。
2.1與植入體匹配的系統信號輸出
2.1.1刺激脈沖幅度
應提供最大刺激脈沖幅度和誤差。
2.1.2刺激脈沖寬度
應提供刺激脈沖寬度的范圍和誤差。
2.1.3單個通道刺激脈沖頻率
應提供單個通道刺激脈沖頻率的范圍和誤差。
2.1.4最大總刺激脈沖頻率
應提供最大總刺激脈沖頻率和誤差。
2.1.5射頻傳輸頻率
應提供射頻傳輸頻率及場強。
2.1.6射頻傳輸距離
應提供射頻傳輸的范圍。
2.2電—聲聯合刺激(EAS)中的聲刺激要求
如適用,具備電—聲聯合刺激功能的聲音處理器的聲輸出部分應符合GB/T 14199-2010(電聲學—助聽器通用規范)的要求。具體技術參數包括(但不限于)以下指標:
a)OSPL90
b)滿檔增益(FOG)
c)參考測試增益(RTG)
d)頻率范圍
e)諧波失真
f)等效輸入噪音水平(EIN)
g)感應線圈響應
2.3電流消耗
2.4外觀
外殼應平整光潔,色澤均勻,不應有明顯的凹痕、劃傷,裂縫,毛刺、鋒棱,變形現象。
2.5連接安裝性能
人工耳蝸聲音處理器的各部件插接、安裝應牢固可靠。
2.6操控性能
人工耳蝸聲音處理器上各控制開關旋鈕應靈活可靠,操作方便,工作正常。
2.7提示功能
聲音處理器應具備以光或聲音的形式對系統各部件和功能的運行情況提供提示,其中可包括但不僅限于:
a)麥克風收音狀態指示
b)線圈掉落并失去射頻連接的提示
c)電池電量顯示和提示
d)系統故障狀態
e)程序檔的狀態
可采用表格形式列出各種提示功能。
2.8線圈頭件對頭皮壓力的要求
明確植入者皮膚上施加的壓力。
2.9遙控器要求
如適用,應給出無線傳輸的范圍和主要功能。
2.10其它附件的要求
2.11說明書聲稱的其他功能
2.12環境試驗
應符合GB/T 14710-2009中氣候環境Ⅱ組和機械環境Ⅱ組的規定。符合的項目至少包括刺激脈沖幅度、刺激脈沖寬度
2.13電氣安全要求
產品應符合GB 9706.1-2007、 GB 9706.15-2008(檢測報告中注明輔助檢測設備)的要求,電氣安全特征見附錄A。
2.14電磁兼容
2.14.1電磁兼容性能應符合YY 0505中1組B類的要求。
2.14.2 如適用,應符合GB/T 25102.13-2010標準要求。
2.15產品應符合GB 16174.1-2015標準的要求。
2.16產品應符合ISO 14708.7-2013標準的要求。
3.1與植入體匹配的系統信號輸出
3.1.1刺激脈沖幅度
依據ISO 14708-7:2013的方法進行檢驗。
3.1.2刺激脈沖寬度
依據ISO 14708-7:2013的方法進行檢驗。
3.1.3單個通道刺激脈沖頻率
依據注冊申請人提供的方法進行檢驗。
3.1.4最大總刺激脈沖頻率
依據注冊申請人提供的方法進行檢驗。
3.1.5射頻傳輸頻率
檢查有資質的第三方出具的檢測報告。
3.1.6射頻傳輸距離
依據注冊申請人提供的方法進行檢驗。
3.2電—聲聯合刺激(EAS)中的聲刺激要求
依據GB/T 14199-2010的方法進行檢驗。
3.3電流消耗
依據注冊申請人提供的方法進行檢驗。
3.4外觀
依據注冊申請人提供的方法進行檢驗。
3.5連接安裝性能
實際操作驗證。
3.6操控性能
實際操作驗證。
3.7提示功能
實際操作驗證。
3.8線圈頭件對頭皮壓力的要求
依據注冊申請人提供的方法進行檢驗。測試時應模擬最小頭皮厚度。
3.9遙控器要求
依據注冊申請人提供的方法進行檢驗。
3.10其它附件的要求
依據注冊申請人提供的方法進行檢驗。
3.11說明書聲稱的其他功能
依據注冊申請人提供的方法進行檢驗。
3.12環境試驗
依據GB/T 14710-2009的方法進行檢驗。
3.13電氣安全要求
依據GB 9706.1-2007、GB 9706.15-2008標準進行檢驗。
3.14電磁兼容
3.14.1依據YY 0505中1組B類的要求進行檢驗。
3.14.2 依據GB/T 25102.13-2010標準進行檢驗。
3.15依據GB 16174.1-2015標準進行檢驗。
3.16依據ISO 14708.7-2013標準進行檢驗。
附錄A 產品安全特征
1.按防電擊類型分類:
2.按防電擊的程度分類:
3.按對進液的防護程度分類:包括處理器與麥克風、防水保護殼
4.按在與空氣混合的易燃麻醉氣或與氧或氧化亞氮混合的易燃麻醉氣情況下使用時的安全程度分類:
5.按運行模式分類:連續運行設備
6.設備的額定電壓和頻率:包括充電電池與內部電源供電設備
7.設備的輸入功率:
8.設備是否具有對除顫放電效應防護的應用部分:
9.設備是否具有信號輸出或輸入部分:應有具體描述
10.永久性安裝設備或非永久性安裝設備:
11.電氣絕緣圖

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《

附件:血液透析用水處理設備注冊審查指導原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設備注冊審查指導原則(2024年修訂版)本指導原則旨在指導注冊申請人對血液透析用水處理設備注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對血液透析用水處理設備的一般要求,注冊申請人依據產品的具體特性確定其中內容是否適用。若不適用,要具體闡述理由及相應的科學依據,并依據產

本指導原則旨在幫助和指導注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術審評的基本要求。同時有助于審評機構對該類產品進行科學規范的審評,提高審評工

國家藥監局關于發布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據

國家藥監局藥審中心關于發布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發布日期:20241010

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管

國家藥監局器審中心關于發布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發布時間:2024-10-14為進一步規范

附件:醫用透明質酸鈉創面敷料注冊審查指導原則(2024年第21號).doc醫用透明質酸鈉創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫醫用透明質酸鈉創面敷料注冊申報資料,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對醫用透明質酸鈉創面敷料產品的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對

附件:重組膠原蛋白創面敷料注冊審查指導原則(2023年第16號).doc重組膠原蛋白創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫重組膠原蛋白創
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
