長江三角洲區域醫療器械注冊人制度試點工作實施方案(試行)(滬藥監械管〔2019〕112號)
為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械
來源:醫療器械注冊代辦 發布日期:2017-08-10 閱讀量:次
附件:牙科種植機注冊技術審查指導原則(2017年第124號).doc
本指導原則旨在指導申請人提交牙科種植機的注冊申報資料,同時規范牙科種植機的技術審評要求。
本指導原則是對牙科種植機的一般性要求,申請人應根據牙科種植機的特性提交注冊申報資料,判斷指導原則中的具體內容是否適用,不適用內容詳述理由。申請人也可采用其他滿足法規要求的替代方法,但應提供詳盡的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下、并參考了國外法規與指南、國際標準與技術報告制定的。隨著法規和標準的不斷完善,以及認知水平和技術能力的不斷提高,相關內容也將適時進行修訂。
本指導原則是對申請人和審查人員的指導性文件,不包括審評審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。
牙科種植機的管理類別為II類,分類編碼為6855(口腔科設備及器具),屬于口腔科手術設備。
本指導原則適用于電力驅動式的牙科種植機。牙科種植機是一種提供種植手術用器械所需的驅動力,用于實施牙科種植手術的醫用電氣設備。
(一)產品名稱的要求
應使用“牙科種植機”作為產品名稱。
(二)產品適用范圍的要求
產品適用于牙科種植治療。
(三)產品綜述資料
牙科種植機根據不同的結構,分為內置式、網電源供電和內部電源供電三種。
申請人應提交器械的完整描述,包括所有型號、規格及配置。
1.說明牙科種植機的結構,提供原理(組成)框圖及實物圖。內容應足夠詳盡,便于評估器械的性質和操作。
(1)例如內置式牙科種植機可描述如下:
該結構的產品作為模塊安裝在牙科治療機內,由牙科治療機供電,并通過牙科治療機的控制臺面板和腳踏開關預設或調節與種植手術操作步驟相對應的功能。
該結構的產品由功能控制電路、馬達線纜、馬達、手機、腳踏開關等組成。框圖如下:
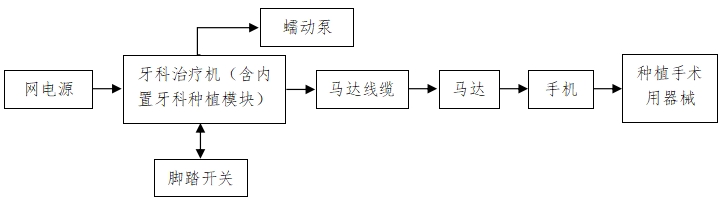
(2)例如網電源供電的牙科種植機可描述如下:
該結構的產品作為獨立設備由網電源供電,通過主機和腳踏開關預設或調節與種植手術操作步驟相對應的功能,將電能和信號通過馬達線纜傳遞給馬達,馬達驅動手機,手機驅動種植手術用器械實施手術。
該結構的產品由主機、蠕動泵、馬達線纜、馬達、手機、腳踏開關等組成。框圖如下:
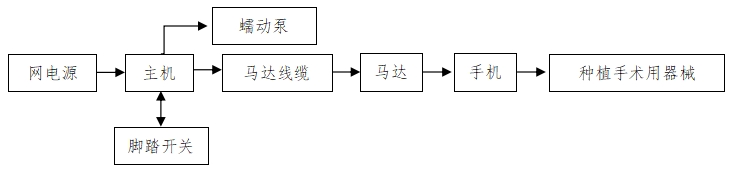
(3)例如內部電源供電的牙科種植機可描述如下:
該結構的產品作為獨立設備由電池供電,通過主機的控制單元直接控制電機輸出機械力驅動種植手術用器械實施手術。
該結構的產品由主機、電池、充電座、手機等組成。框圖如下:

2.提供產品的技術規格(技術指標);當器械與相關標準有差異時,應著重說明。
3.申請人應明確各組成單元。
(1)主機
由網電源(AC220V)直接供電,或由電池供電,為手機提供機械動力能和/或電能。通過操作控制臺面板和腳踏開關,預設或調節與種植手術操作步驟相對應的功能。一般情況下,轉速、手機的齒輪速比選擇、扭矩控制、正反轉功能、冷卻水流量的調節及狀態均在控制臺面板上操作及顯示。
(2)馬達線纜
用于在控制臺與馬達之間實現電能傳輸。
(3)馬達
馬達通過馬達線纜與控制臺完成電氣相連并由后者供電,用于提供旋轉種植手術用器械的驅動力。
(4)手機
由操作者握持,其驅動所夾持的種植手術用器械來實現手術目的的部件。在臨床上需根據轉速及扭矩需求配備不同齒輪速比的手機。
(5)腳踏開關
接入主機或牙科治療機后,用于控制種植手術操作步驟相對應的功能選擇和啟停切換。
(6)蠕動泵
由牙科治療機或主機控制,用于在種植手術過程中提供工作區域的水冷卻、沖洗的動力,包括冷卻液的流量調整。
4.申請人應說明整機配置。
整機配置應覆蓋所有組合情況。同一型號的整機應考慮根據主機、馬達、腳踏開關、手機等主要部件的不同組合方式劃分為不同的配置。
例如某一型號AAA的牙科種植機含主機(型號X)、馬達(型號Y1、型號Y2)、手機(型號Z)、腳踏開關(無線型號W1、有線型號W2),則AAA型號的配置應至多包括X+Y1+Z+W1、X+Y1+Z+W2、X+Y2+Z+W1、X+Y2+Z+W2等4種配置,并以實際申報組合情況確定最終配置。
(四)研究資料
1.生物相容性研究資料
牙科種植機產品組成中若包括手機部分,本章節適用。
手機看作機頭與機身的組合構造。考慮臨床使用中機頭部分在口內操作,會與口腔內生理組織接觸,因此應評價手機機頭部分的生物學風險。申請人應描述機頭部分的材料,以及在使用過程中與口腔黏膜組織接觸的性質和時間,參照GB/T 16886.1—2011《醫療器械生物學評價 第1部分:風險管理過程中的評價與試驗》或者YY/T 0268—2008《牙科學 口腔醫療器械生物學評價 第1單元:評價與試驗》的要求對手機機頭部分進行生物相容性評價。
2.滅菌工藝研究資料
(1)手機
手機應可耐受滅菌處理,并參照YY 1045.2《牙科手機 第2部分 直手機和彎手機》的要求能夠承受一定次數的滅菌循環,而無損壞現象。滅菌方式宜采用壓力蒸汽滅菌。如采用其他滅菌方式,應提供該滅菌方法及其確定的依據。提供推薦的滅菌方法耐受性的研究資料。
(2)馬達及馬達線纜
若適用,馬達及馬達線纜可耐受滅菌處理,應參照YY 0836—2011《牙科手機 牙科低壓電動馬達》的要求能夠承受一定次數的滅菌循環,而無損壞現象。滅菌方式宜采用壓力蒸汽滅菌。如采用其他滅菌方式,應提供該滅菌方法及其確定的依據。提供推薦的滅菌方法耐受性的研究資料。
(五)注冊單元劃分
1.內置式牙科種植機、網電源供電的牙科種植機、內部電源供電的牙科種植機應劃分為不同的注冊單元。
2.供水管路、種植手術用器械均不應劃入牙科種植機的注冊單元。
3.若牙科種植用手機的接口為符合YY 1012—2004《牙科手機聯軸節尺寸》的通配接口,建議將手機作為獨立的注冊單元進行申報,手機應符合本指導原則附錄3的要求;若馬達、手機為專配,可將馬達、手機劃入牙科種植機的注冊單元。
(六)檢測單元劃分
檢測樣機的選取應考慮產品功能、性能、預期用途、安全指標、主要部件、結構及其組合方式等,應以不同配置(見綜述資料“整機配置說明”)而非不同型號的結果作為劃分檢測單元的依據。以“整機配置說明”涉及內容為例,應考慮:
1.由于主機、馬達、手機、腳踏開關等主要部件在整機中起的作用較大,其不同的配置影響到了整機的安全和性能要求,因此應考慮4種配置下的安全和性能檢測報告。
2.電磁兼容安全要求須覆蓋全部4種配置。
3.醫用電氣設備在實施GB 9706.1—2007《醫用電氣設備 第1部分:安全通用要求》標準全項檢測時,應對電磁兼容性能按照電磁兼容標準要求實施檢測。安規檢測報告和EMC檢測報告應具有關聯性。
(七)產品適用的標準
如下表格列出牙科種植機主要涉及的現行有效的國家/行業標準;如有標準發布或更新,應考慮新版標準的適用性。國家/行業標準中不適用條款應在產品性能研究資料中說明合理原因。
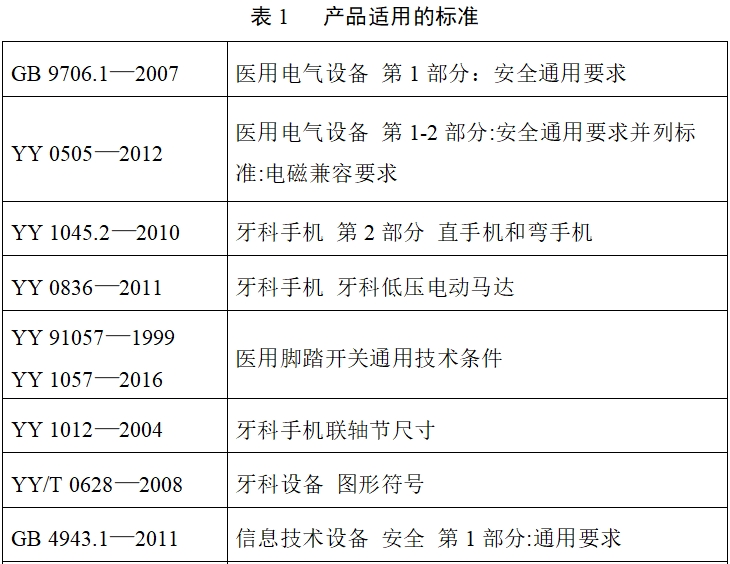
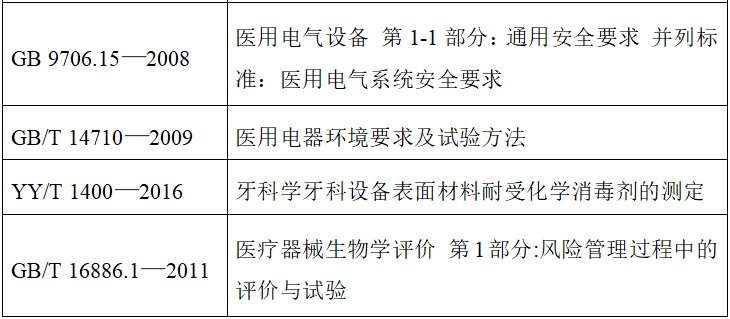

(八)產品技術要求及檢測應注意的問題
1.內置式牙科種植機,應和配合使用的牙科治療機在連接或結合狀態下符合GB 9706.1—2007《醫用電氣設備 第1部分:安全通用要求》、YY 0505—2012《醫用電氣設備 第1-2部分:安全通用要求并列標準:電磁兼容要求》的要求。
2.內部電源供電的牙科種植機,其組成中若含有充電座,則:
若充電座在患者環境下使用,充電座應符合GB 9706.1—2007《醫用電氣設備 第1部分:安全通用要求》的要求;
若充電座在非患者環境下使用,充電座應符合相應電氣安全的標準要求,且包括充電座在內的牙科種植機應符合GB 9706.15—2008《醫用電氣設備 第1-1部分:通用安全要求 并列標準:醫用電氣系統安全要求》、YY 0505—2012《醫用電氣設備 第1-2部分:安全通用要求并列標準:電磁兼容要求》的標準要求。
3.本指導原則以網電源供電的牙科種植機為實例,提供了產品技術要求書寫模板,見本指導原則的附錄1。
(九)產品說明書
牙科種植機的產品說明書應符合《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)和相關標準中的要求,并包括:
1.工作環境(至少包括濕度和溫度);
2.種植機馬達的轉速和轉矩,或和手機配合使用后的轉速和轉矩;
3.種植機馬達、馬達線纜是否可滅菌的說明;
4.若適用,懸掛裝置的最大允許負載;
5.牙科種植機的清潔及消毒說明;
6.推薦的冷卻液的種類和使用方法;
7.若適用,推薦光源;
8.若可和其他制造商生產的附件配合使用,在牙科種植機的說明書中應規定這些附件的特性;
9.若適用,明確滅菌周期的重要參數,例如時間、溫度和壓力;
10.熱傷害的警示;
11.潤滑劑傷害的警示;
12.說明牙科種植機用水所要求的質量,包括水的硬度范圍。
(十)臨床評價資料
牙科種植機列入《免于進行臨床試驗的第二類醫療器械目錄》(國家食品藥品監督管理總局通告2016年第133號,以下簡稱《目錄》),對應的序號為190。申請牙科種植機的注冊,可免于進行臨床試驗。注冊申請人參照《醫療器械臨床評價技術指導原則》的要求,提交相應的臨床評價資料。
列入《目錄》的產品,注冊申請人需提交申報產品相關信息與《目錄》所述內容的對比資料和申報產品與已獲準境內注冊的《目錄》中醫療器械的對比說明,如相應對比說明能夠證明產品是《目錄》中的產品,則企業無需進行臨床試驗。若無法證明申報產品與《目錄》產品具有等同性,則應按照《醫療器械臨床評價技術審查指導原則》其他要求開展相應工作。
(十一)其他資料
1.風險管理報告應符合YY/T 0316—2016《醫療器械 風險管理對醫療器械的應用》的有關要求,具體編寫可參考附錄2 風險管理資料的要求。
2.軟件資料應符合《醫療器械軟件注冊技術審查指導原則》的要求。
(一)《醫療器械臨床評價技術指導原則》(國家食品藥品監督管理總局通告2015年第14號)
(二)《醫療器械軟件注冊技術審查指導原則》(國家食品藥品監督管理總局通告2015年第50號)
(三)《醫療機構口腔診療器械消毒技術操作規范》(國家衛生和計劃生育委員會,衛醫發﹝2005﹞73號)
(四)GB/T 9937.3—2008 口腔詞匯 第3部分:口腔器械
(五)YY/T 0752—2016 電動骨組織手術設備
(六)FDA Document-Guidance for Industry and FDA Staff: Dental Handpieces - Premarket Notification [510(k)] Submissions.
(七)FDA Document-Dental Handpiece Sterilization.
(八)ISO 14457-2012: Dentistry-Handpieces and Motors.
本指導原則包括適用范圍、技術審查要點、附錄等三部分內容,主要規定了以下內容:
第一,明確了本指導原則的適用范圍和牙科種植機的三種結構形式;
第二,明確了申報產品綜述資料、研究資料的要求;
第三,明確了產品適用的標準、劃分注冊單元、劃分檢測單元的要求、產品技術要求和檢測報告應注意的問題、并附產品技術要求模板;
第四,明確了產品說明書與標簽相關要求;
第五,明確了獨立申報牙科種植用手機的注冊要求。
國家食品藥品監督管理總局醫療器械技術審評中心
附錄:1.產品技術要求模板
2.風險管理資料
3.牙科種植用手機技術審查要點
附錄1
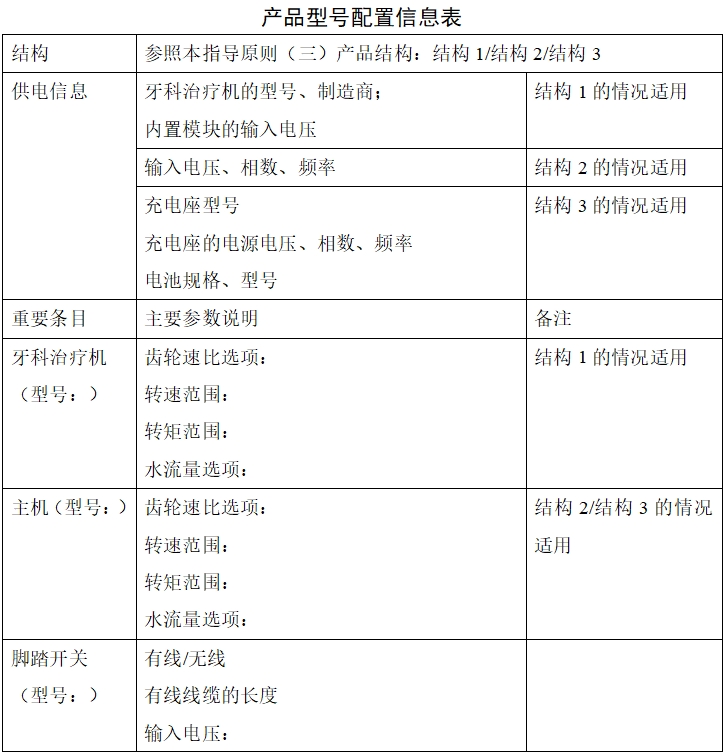
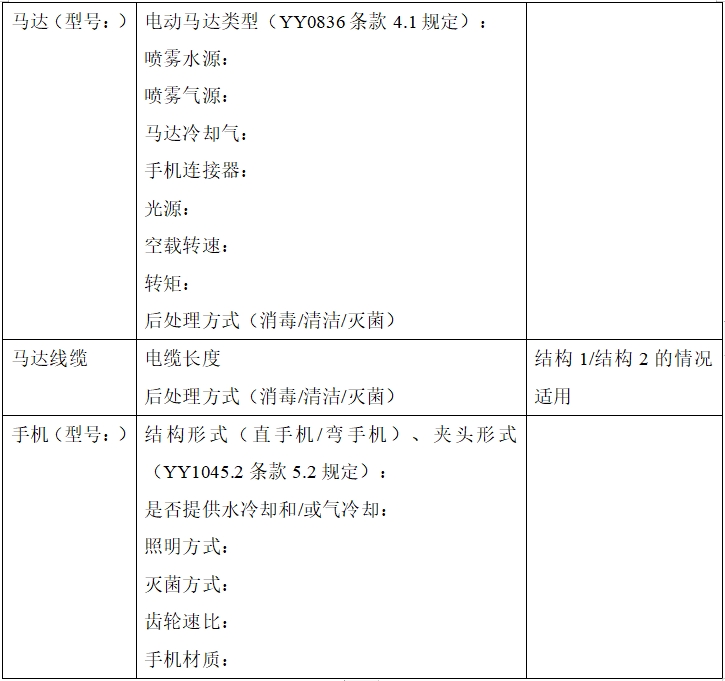
1.1產品型號規格及劃分說明
1.2提供產品型號配置表(詳見下表,如含多種配置,應增加表格內容)
1.3軟件發布版本
1.4版本命名規則
明確軟件完整版本的全部字段及字段含義。
2.性能指標
2.1應符合YY/T 1485—2016的要求。
2.2手機符合YY 1045.2—2010的要求。
2.3腳踏開關的功能要求
腳踏開關應具備制造商在隨機文件或使用說明書中規定的各項功能。
2.4安全要求
應符合GB 9706.1—2007、YY 0505—2012的要求。產品安全特征詳見附錄。
2.5環境試驗要求
應符合GB/T 14710—2009的要求。
2.6軟件功能要求。
3.試驗方法
3.1按照YY/T 1485—2016的要求進行試驗,結果應符合2.1的要求。
3.2按照YY 1045.2—2010的要求進行試驗,結果應符合2.2的要求。
3.3按照使用說明書的規定,對主要功能進行逐項檢查,核實其能否正常工作。
3.4安全要求
按照GB 9706.1—2007、YY 0505—2012的要求進行試驗,結果應符合2.4的要求。
3.5產品的環境試驗應按照GB/T 14710—2009的規定的方法及程序執行。
3.6軟件功能。
附錄
產品安全特征(11項)、電氣絕緣圖、電氣絕緣表格
附錄2
本文件識別出了與牙科種植機產品相關的主要風險,并給出了緩解(降低或減輕)這些風險的建議方法。申請人若使用替代方法來緩解本文件中指出的特定風險,或者確定了除了本文件中以外的其他風險,申請人應該提供足夠的細節信息來支持所用的方法。
1.產品的風險管理報告應符合YY/T 0316《醫療器械 風險管理對醫療器械的應用》的有關要求,判斷與產品有關的危害,估計和評價相關風險,控制這些風險并監視控制的有效性。申請人提供注冊產品的風險管理報告應扼要說明:
(1)在產品的研制階段,已對其有關可能的危害及產生的風險進行了估計和評價,并有針對性地實施了降低風險的技術和管理方面的措施;
(2)在產品性能測試中部分驗證了這些措施的有效性,達到了通用和相應專用標準的要求;
(3)對所有剩余風險進行了評價;
(4)全部達到可接受的水平;
(5)注冊申請人對產品的安全性的承諾。
2.風險管理報告的內容至少包括:
(1)產品的風險管理組織;
(2)產品的組成及預期用途;
(3)風險報告編制的依據;
(4)產品與安全性有關的特征的判定。
申請人應按照YY/T 0316《醫療器械 風險管理對醫療器械的應用》附錄C的34條提示,對照產品的實際情況作出針對性的簡明描述。
注意:產品如存在34條提示以外的可能影響安全性的特征,也應作出說明。
(5)對產品的可能危害、可預見事件序列和危害處境的判定。
申報方應根據自身產品特點,根據YY/T 0316《醫療器械 風險管理對醫療器械的應用》附錄E、I的提示,對危害、可預見事件序列、危害處境及可導致的損害作出判定。
(6)風險可接收準則:降低風險的措施及采取措施后風險的可接收程度,是否有新的風險產生。
(7)風險控制的方案與實施、綜合剩余風險的可接受性評價及生產和生產后監視的相關方法,可參考YY/T 0316《醫療器械 風險管理對醫療器械的應用》的附錄F、G、J。


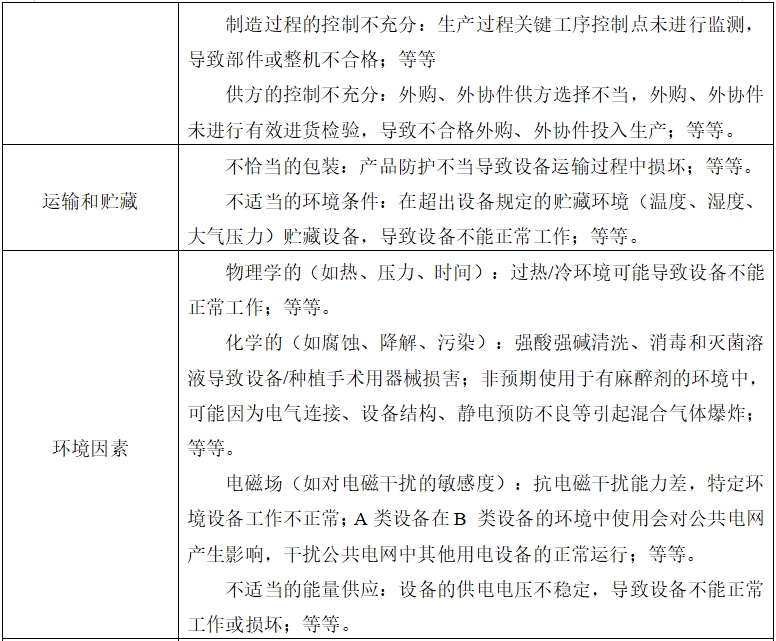



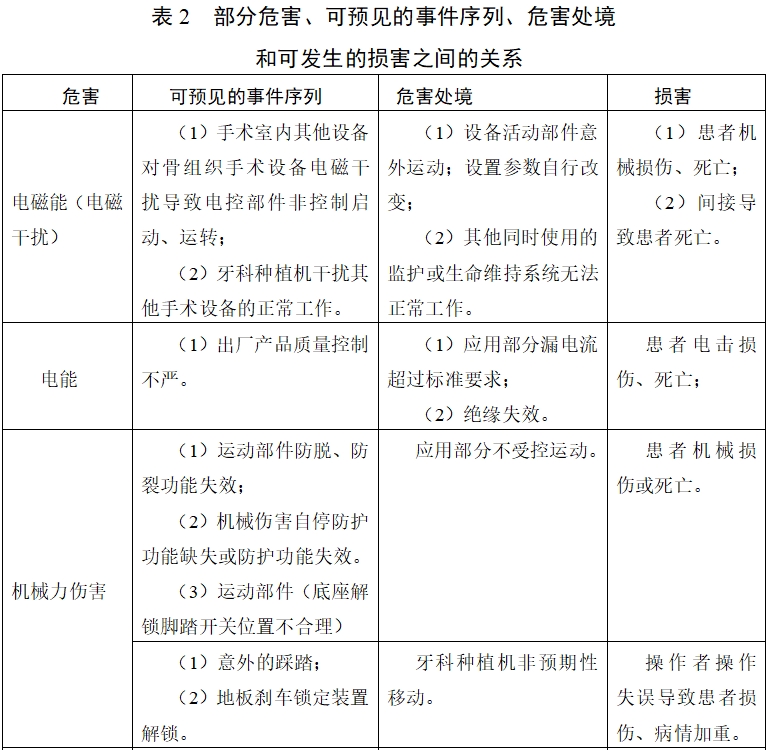
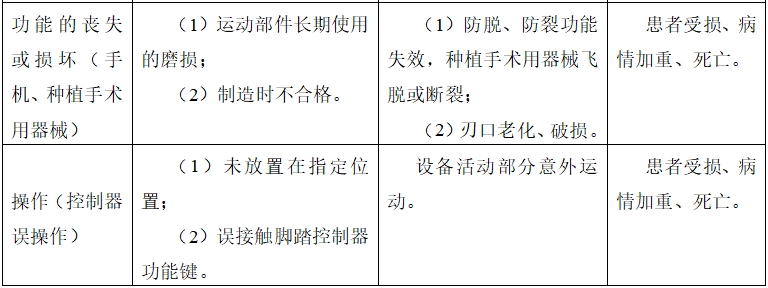

表1、表2依據YY/T 0316《醫療器械 風險管理對醫療器械的應用》的附錄E 提示性列舉了牙科種植機可能存在危害的初始事件和環境,示例性地給出了危害、可預見的事件序列、危害處境和可發生的損害之間的關系,給審查人員予以提示、參考。
由于牙科種植機的原理、功能和結構的差異,本章給出的風險要素及其示例是常見的而不是全部的。上述部分只是風險管理過程的組成部分,不是風險管理的全部。注冊申請人應按照YY/T 0316《醫療器械 風險管理對醫療器械的應用》中規定的過程和方法,在產品整個生命周期內建立、形成文件和保持一個持續的過程,用以判定與醫療器械有關的危害、估計和評價相關的風險、控制這些風險并監視上述控制的有效性,以充分保證產品的安全和有效。
附錄3
本部分內容僅適用于牙科種植治療時使用的牙科手機(以下簡稱為手機)。
手機的管理類別為Ⅱ類,分類編碼為6855(口腔科設備及器具)。
(一)產品名稱的要求
若手機中包含牙科彎手機和牙科直手機,應使用“牙科手機”作為注冊產品名稱;若手機僅為單獨的牙科彎手機或牙科直手機,應使用“牙科彎手機”或“牙科直手機”作為注冊產品名稱。
(二)產品的適用范圍
產品適用于牙科種植治療。
(三)術語解釋
1.牙科手機:用于向牙科工具或器具傳遞(帶轉換或不帶轉換)工作所需能量的手持工具。
2.彎手機:主軸與被夾工具或器具呈角度的牙科手機,其輸入軸與輸出軸之間具有角度。牙科手機的一種結構方式。
3.直手機:用來向器具傳遞和/或轉換旋轉運動的手機,其軸與手機主軸相重合。牙科手機的一種結構方式。
4.照明方式分為帶照明裝置式、導光式、無照明式三種方式。
(1)帶照明裝置式:牙科手機結構中含照明光源。
(2)導光式:牙科手機結構不含照明光源,但結構中含有導光裝置。照明光源通過可彎曲的導光纖維束(玻璃或石英)傳導外部照明光源提供的光照。該導光裝置可射出光束,直接導向所需區域。
(3)無照明式:牙科手機結構既不含照明光源,又不帶導光裝置。
(四)研究資料
1.生物相容性評價資料
申請者應參照本文中牙科種植機的手機部分的生物相容性評價資料要求,提供手機機頭部分的生物相容性評價資料。
2.滅菌工藝研究資料
手機須耐受滅菌。申請者應參照本文中牙科種植機的手機部分的滅菌/消毒工藝研究資料要求,提供手機的滅菌工藝研究資料。
(五)注冊單元劃分的原則
帶照明裝置式的手機與無照明式的手機應劃分為不同的注冊單元;導光式與無照明式的手機可放在同一注冊單元。
(六)檢測單元劃分的原則
1.增速手機和減速手機應劃分為不同的檢測單元。增速手機應選取齒輪傳送比最小的產品作為檢測的典型產品,減速手機中應選取齒輪傳送比最大的產品作為檢測的典型產品。
2.夾頭形式不同的手機應劃分為不同的檢測單元。
3.本身不帶獨立照明裝置需由導光裝置傳導外部照明光源提供的光照的手機和無照明功能的手機可選取前者作為檢測的典型產品。
(七)產品適用的相關標準
如下表格列出手機主要涉及的現行有效的國家/行業標準;如有標準發布或更新,應考慮新版標準的適用性。

(八)產品技術要求
1.應列表明確產品型號、結構形式(直手機/彎手機)、夾頭形式(YY 1045.2—2010條款5.2規定)、是否提供水冷卻和/或氣冷卻、照明方式(帶照明裝置式/導光式/無照明式)、滅菌方式、齒輪速比、手機材質。
2.性能指標
(1)產品應符合YY 1045.2—2010的條款5、8、9的要求。
(2)產品應符合GB 9706.1—2007、YY 0505-2012的要求。(照明方式為帶照明裝置式的手機適用)
(3)環境試驗要求
產品的環境試驗應按照GB/T 14710—2009的規定的方法及程序執行。(照明方式為帶照明裝置式的手機適用)
3.試驗方法
(1)按照YY 1045.2—2010的條款7的試驗方法進行檢測,結果應符合2.(1)的要求。
(2)按照GB 9706.1—2007、YY 0505—2012的試驗方法進行試驗,結果應符合2.(2)的要求。
(3)環境試驗
產品的環境試驗應按照GB/T 14710—2009的規定的方法及程序執行。
(九)產品說明書
除符合《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)和相關標準中的要求之外,手機的說明書還應至少明確以下信息:
1.明確手機(含易損件如軸承、水路等)的滅菌、維護、保養說明;明確滅菌周期的重要參數,例如時間、溫度;明確干燥說明。
2.明確夾持的手術器械類型、規格、尺寸;
3.若帶水冷卻,明確水冷卻方式(外給水/內給水),水源的壓力及基本要求;
4.在驅動馬達的最大轉速下,手機的空載轉速;
5.明確手機夾頭形式、聯軸節類型。
(十)臨床評價資料
牙科種植機列入《免于進行臨床試驗的第二類醫療器械目錄》(國家食品藥品監督管理總局通告2016年第133號,以下簡稱《目錄》),對應的序號為190。牙科種植機用手機為牙科種植機組成的一部分,且二者適用范圍一致。申請牙科種植機用手機的注冊,可免于進行臨床試驗。注冊申請人參照《醫療器械臨床評價技術指導原則》的要求,提交相應的臨床評價資料。
列入《目錄》的產品,注冊申請人需提交申報產品相關信息與《目錄》所述內容的對比資料和申報產品與已獲準境內注冊的《目錄》中醫療器械的對比說明,如相應對比說明能夠證明產品是《目錄》中的產品,則申請人無需進行臨床試驗。若無法證明申報產品與《目錄》產品具有等同性,則應按照《醫療器械臨床評價技術審查指導原則》其他要求開展相應工作。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《

附件:血液透析用水處理設備注冊審查指導原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設備注冊審查指導原則(2024年修訂版)本指導原則旨在指導注冊申請人對血液透析用水處理設備注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對血液透析用水處理設備的一般要求,注冊申請人依據產品的具體特性確定其中內容是否適用。若不適用,要具體闡述理由及相應的科學依據,并依據產

本指導原則旨在幫助和指導注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術審評的基本要求。同時有助于審評機構對該類產品進行科學規范的審評,提高審評工

國家藥監局關于發布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據

國家藥監局藥審中心關于發布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發布日期:20241010

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管

國家藥監局器審中心關于發布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發布時間:2024-10-14為進一步規范

附件:醫用透明質酸鈉創面敷料注冊審查指導原則(2024年第21號).doc醫用透明質酸鈉創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫醫用透明質酸鈉創面敷料注冊申報資料,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對醫用透明質酸鈉創面敷料產品的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對

附件:重組膠原蛋白創面敷料注冊審查指導原則(2023年第16號).doc重組膠原蛋白創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫重組膠原蛋白創
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
