有源醫療器械加速老化試驗效期驗證及使用期限驗證流程
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有
來源:醫療器械注冊代辦 發布日期:2024-05-22 閱讀量:次
5月20日,四川省藥監局通過其官方微信公眾號整理了第二類醫療器械注冊申報中的常見問題,并進行權威答疑。現為大家整理匯總如下:

Q1:第二類醫療器械注冊人在注冊申報前搬遷生產地址,現申報生產地址與原檢驗用產品和臨床試驗用產品生產地址不一致時,應如何辦理?
A1:注冊申請人應按照《四川省第二類醫療器械注冊質量管理體系核查工作程序》第二十四條相關要求 “申請人完成產品檢驗后,因規劃調整、房屋拆遷等特殊原因需要變更生產地址的,可向省局提出申請,在地址變更前,由省審評中心提前開展檢驗用產品和臨床試驗用產品的真實性及相應體系核查。在后續技術審評過程中組織的體系可不進行產品真實性核查。”
Q2:對于試產用于注冊自檢的樣品,其成品檢驗和注冊自檢是否可以共同開展?
A2:注冊申請人應按照《醫療器械生產質量管理規范》《醫療器械注冊自檢管理規定》等規定,建立自檢相關的要求并實施注冊自檢。在成品檢驗的項目和注冊自檢的項目、檢驗方法等完全一致的情況下可以共同開展,無需重復完成兩次檢驗。
Q1:體外診斷試劑溯源是否必須溯源到國家標準品?
A1:不需要。有適用國家標準品的項目,應使用國家標準品進行產品檢驗。溯源時可溯源至適用的國際標準品、參考測量程序或已上市同類產品的測量體系。
Q2:有適用國家標準品的體外診斷試劑產品技術要求中是否需要明確國家標準品符合性要求?
A2:需要。對于有適用的國家標準品的體外診斷試劑,產品技術要求性能指標應明確國家標準品名稱、組成等信息,并明確性能指標要求。若是在產品注冊證有效期內新發布適用的國家標準品,注冊人應及時變更產品技術要求。
Q3:為縮短研發周期,分析性能評估和穩定性研究用試劑能否采用研發實驗室生產的小試樣品?
A3:不能。分析性能評估和穩定性研究用試劑應為原材料和生產工藝經過選擇和確定后,在有效質量管理體系下生產的體外診斷試劑產品。申請人研發實驗室的生產條件(工藝、環境、設備、人員等)與生產車間不一致,因此申請人研發實驗室配制試劑的分析性能評估資料和穩定性研究資料不作為注冊資料提交。
Q4:體外診斷試劑產品,在提交補正資料時,可否根據研究進展延長有效期?
A4:按照《四川省醫療器械快速審評審批辦法》第七條“對于體外診斷試劑產品,在提交補正資料時,可根據研究進展新增適用機型或變更有效期”,申請人可以在提交補正資料時根據研究進展延長效期,但考慮到體系核查完整性以及補正資料時限等因素,延長效期不應超過六個月。
來源:四川藥監

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
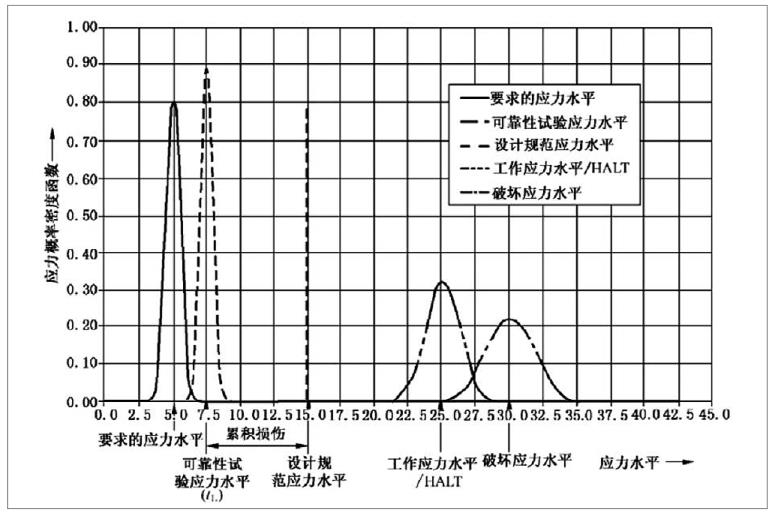
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有

環氧乙烷滅菌是一種廣譜、高效、穿透力強、對消毒物品損害輕微的滅菌方法。環氧乙烷分子式C2H4O,分子量44.05。它的蒸氣壓比較大,可以穿透微孔而達到物品的深部。其液體和氣體均

國家市場監管總局于官網公布《藥品注冊管理辦法》(以下簡稱“辦法”)已于2020年7月1日起正式施行。國家藥監局從《辦法》修訂的背景、思路、引入了哪些新理念和制度、有哪些鼓

2020年6月29日,國務院發布《化妝品監督管理條例》(國令第727號),規定化妝品新原料需向國務院藥品監督管理部門申請注冊或者備案后才能用于化妝品中。
中國是世界上最有潛力的醫療器械市場及最大市場之一,許多醫療器械進出口貿易商或國外有實力的企業希望能夠按照中國藥監局醫療器械注冊監管要求獲得中國市場的上市準入。考慮

醫療器械注冊費是行政性收費,按照注冊單元收取,部分省份不收取醫療器械注冊費用,絕大部分省份還是收取的。本篇文章統計了截止到2022年1月5日各地醫療器械注冊收費標準。

中國能排進世界十大醫療器械制造強國嗎?暫時還不能,因為排進前十的國家都有許多知名械企和世界級醫療器械巨頭;而中國比較出名的可能只有邁瑞了,其他械企仍需努力了。下面

2020年3月17日國家藥監局發布了關于醫療器械主文檔登記事項的公告(2021年第36號),之前給大家介紹過醫療器械主文檔的主要內容、適用的產品注冊類型等信息。今天我們再來向大家介

本文介紹了歐盟醫療器械新法規MDR相比于將替代的MDD法規的幾點新增要求。建議收藏學習。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)將替代原本的Medical Devices Directive (93

簡述了中藥新藥臨床試驗主要特點,指出要重視風險、受益評估,重視人 用經驗選擇科學、客觀、合適的有效性指標,做好中醫證候療效評價,鼓勵在中藥新藥臨床研究中采用電子化手
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
