醫療器械注冊單元劃分概述——注冊單元劃分常見問題解答
從事醫療器械注冊的小伙伴們可能都為同一個問題苦惱過,那就是醫療器械注冊單元的劃分。企業所設計開發出的產品,其所包含的產品范圍,是否可通過一個注冊單元完成注冊,從而
來源:醫療器械注冊代辦 發布日期:2025-09-02 閱讀量:次
對于醫療器械注冊申報這項工作而言,極有可能出現這樣一種狀況,即企業最害怕面對的或許是收到一份被判定為“不予注冊”的決定書,這一情形不僅使得前期投入宛如石沉大海一般付諸東流,而且會讓精心規劃的產品上市計劃遭受嚴重的打亂,故而充分且全面地去了解各式各樣常見的不予注冊情形并在前期就提前予以規避,從重要程度上來衡量,遠比在事后再去進行困難重重的補救要顯得更為重要許多。

依據《醫療器械注冊與備案管理辦法》以及與之相關的法規條例,我們需深入探究究竟是在何種林林總總的情況之下會致使出現“不予注冊”這般后果呢,而以下所列舉的即為在技術層面上存在的一些相對較為常見的具體原因。
1. 申報資料真實性以及合規性存疑這種在各類情形里堪稱最為嚴重的狀況,一旦被相關方面認定屬實,那么大概率而言基本就不存在任何回旋的可能性與空間,比如說存在數據造假情況,即研發數據、檢測數據以及臨床數據等被證實發生了篡改或者偽造,而監管機構則會運用數據溯源、交叉核對等手段去開展嚴格審查,還存在諸如無法溯源的現象,也就是所提供的資料其原始數據記錄出現缺失、混亂這樣的情形從而無法證明其真實性與可靠性,又或者出現隱瞞情況,像故意隱瞞已知的產品風險、不良事件抑或是同類產品信息。
2. 臨床評價由于未能憑借充分、科學方式證實安全性與有效性而宣告失敗,這其中涵蓋多種情形,像是提交的臨床數據不論是同品種比對數據還是臨床試驗數據都在質量以及數量層面,均不能夠針對產品面向目標人群應用時的安全性與有效性做出全面且科學的有力證實;再者臨床試驗方案設計不合理,像對照組如何進行合理設置以及終點指標該做怎樣選擇等,這些方面存在重大缺陷,致使研究所得結果根本無法對注冊申請形成有力支持;此外,經綜合評價之后發現產品潛在風險顯著高于臨床獲益,并且也沒辦法通過對適用范圍做出適當調整或者增添警示等相關方式來對風險加以控制。
3. 之所以產品質量體系核查未能獲得通過,乃是因在針對注冊質量管理體系所開展的現場核查過程當中被察覺出存在嚴重不符合項這一情形,并且,即便經歷了整改之后,依舊未能夠符合相關要求,由此能夠證明該企業并不具備可以持續性生產出合格產品的能力,然而,此狀況與“發補”里面通常所涉及到的一般不符合項之間有著本質性的區別。
由于申報產品所呈現出的作用機理以及預期用途并不契合《醫療器械監督管理條例》里面針對醫療器械所給出的明確定義,致使該產品極有可能被判定歸類為諸如化妝品、消毒用品、軟件或者普通工業品之類,所以此產品并不屬于醫療器械這一范疇,而針對 2025 年不予注冊的核心風險及其規避策略。
| 風險領域 | 具體表現 | 規避與應對策略 |
|---|---|---|
| 數據真實性 | 數據造假、無法溯源、隱瞞信息 | 建立完備的研發、檢測記錄管理制度;確保所有數據可追溯;誠信申報,主動披露。 |
| 臨床評價 | 數據不充分、設計有缺陷、風險不可控 | 注冊前與審評機構充分溝通方案;尋求資深CRO支持;確保數據能充分證明安全有效性。 |
| 體系核查 | 現場核查發現嚴重缺陷 | 將質量管理體系真正融入日常運營;提前進行內部或第三方模擬審核。 |
| 產品屬性 | 產品定義不清,作用機理不符 | 立項前進行充分的產品定性研究;參考同類產品及官方分類界定結果。 |
需憑借冷靜態度對原因加以分析,即要求將決定書中具體闡述的相關理由以極為仔細認真的方式去全面閱讀,并依據所讀取的內容判斷究竟是涉及到程序方面的相關問題,亦或是那種屬于實質性范疇內的技術性質的缺陷所在。
當面臨與醫療器械相關事宜時,需要立即向那些對醫療器械法規極為熟悉的律師以及注冊專家展開咨詢,從而借助他們的專業力量來針對所做決定之合理性以及后續所存在的各類可能性進行評估,這種尋求專業法律與技術支持的行動刻不容緩。
當一個人認為相關決定的依據處于那種明顯不充分或者其程序出現不具備合法性情形時,從規定的時限角度來看,即在一般所認定的60日這個時間范圍之內,該人有兩條途徑可以選擇,其一為向上一級藥品監督管理部門通過申請這一行為來啟動行政復議程序,另一條路則是朝著人民法院以提起訴訟的方式來進行權利主張,不過需要注意的是,上述這樣的做法通常僅僅適用于處理程序性問題,而若是面對那些實質性的技術問題,那么想要憑借此方式進行挑戰的話,其難度大到超乎想象。
倘若遇到因技術資料方面致使不予注冊之狀況,那么最為務實可行的做法便該是從中汲取教訓,依據那導致不予注冊的具體細致原因,重新去對數據加以補充、將資料予以完善,一直等到各方面條件發展至成熟狀態之時,才能夠再一次開展申報工作;然而,這實際上就意味著需將一切都從起始的最初狀態開始進行,如此一來,無論是時間方面還是經濟層面所需付出的成本無疑都會極為高昂。
結論所指向的是,“不予注冊”這一狀況在應對層面的核心重點,無疑乃是在于“預防” ,而對于企業來說,自項目予以立項的起始階段開始,便應當秉持一種誠信的原則,以此來保證研發進程的規范性得以達成、數據的真實性能夠被實現,同時對質量體系的建設連同運行也要著重予以重視,并且在申報工作開展之前,還需與監管部門展開充分且坦誠的溝通,然而,真正將資源切實投入到扎實的產品研發以及質量提升方面上,才會是避免面臨“不予注冊”這般風險最為根本以及最為有效的途徑所在。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

從事醫療器械注冊的小伙伴們可能都為同一個問題苦惱過,那就是醫療器械注冊單元的劃分。企業所設計開發出的產品,其所包含的產品范圍,是否可通過一個注冊單元完成注冊,從而
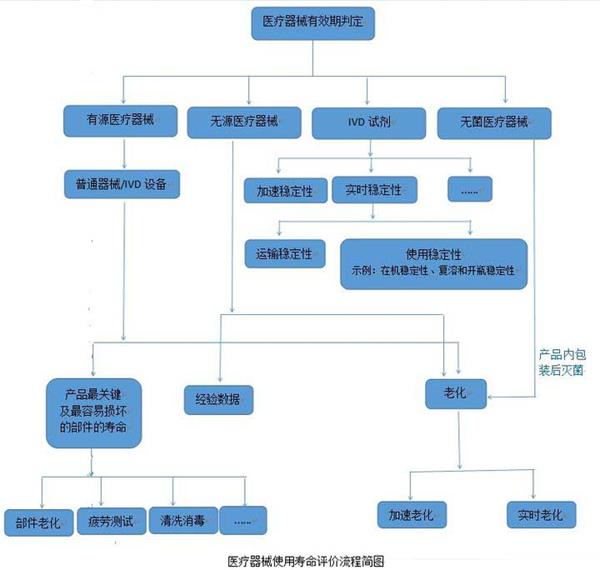
醫療器械的使用壽命是指醫療器械從規劃、設計、生產、銷售、安裝調試到使用、維修、維護檢測、報廢的全過程。而醫院使用的醫療器械的應用質量和安全管理在整個壽命過程中占重

隨著醫療器械出口的日益增長,根據市場的需求各醫療器械生產廠商需要符合國家和地區的質量體系法規越來越多,所以經常會碰到出處于不同法規或標準的一些比較容易混淆的概念及

每年臨研人才市場最為熱鬧的3、4月份就要來了。很多粉絲朋友都是跟著我從CRA一路走到PM的,相信也有不少人下一個職業生涯的目標也是PM這個崗位。湊巧的是,我正好在前段時間經歷

2019-12-01藥物臨床試驗機構(簡稱機構)開始實行備案管理。本文結合機構備案平臺構建思路,著重介紹了備案平臺的結構組成以及相關要求,梳理了機構備案過程中的常見問題,對機構

剛接觸醫療器械CRO行業的小伙伴,在學習文件法規資料的同時,常看到一些英文類專業名詞不知道是什么意思。下面,一起看看常見的醫療器械臨床試驗專業術語......"

2019年5月31日,國家藥監局發布了《關于實施醫療器械注冊電子申報的公告(2019年第46號)》,從2019年6月24日正式實施電子申報,從11月1日起提交國家局的注冊資料都需要按照電子申報目錄

醫療器械注冊證是依照法定程序,對擬上市銷售、使用的醫療器械的安全性、有效性進行評價,決定同意其銷售、使用后發放的證件,由國家食品藥品監督管理總局統一制定。"
眾所周知,醫療器械分為三類,一類采用備案制,二三類采用注冊制管理,等級越高,管理越嚴格。一類醫療器械都是免臨床的,因此備案工作比較簡單不繁瑣。而二三類醫療器械除免臨床產品
臨床試驗得出正確的結論需要嚴謹的試驗設計,雙盲隨機平行對照臨床試驗仍是證據等級最高的原始研究。根據《醫療器械臨床試驗設計指導原則》(2018年第6號)(下稱《原則》),隨
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
