臨床崗位科普|CRA/CTA/CRC/CRO/DM/PV/RA是什么意思?
大多數(shù)剛畢業(yè)的同學(xué)在準(zhǔn)備進(jìn)入臨研圈的時(shí)候,一定會(huì)被鋪天蓋地的行業(yè)專有名詞搞得暈頭轉(zhuǎn)向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請(qǐng)問(wèn)貴司CEO接受應(yīng)屆生嗎?


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2023-10-10 閱讀量:次
?

引言:即使是剛接觸臨床試驗(yàn)的小伙伴,對(duì)于盲法應(yīng)該也不陌生,但對(duì)于“非盲”這個(gè)概念可能還不是那么普及。那么今天就針對(duì)“什么是非盲”,和大家簡(jiǎn)單的說(shuō)一說(shuō)。文章由淺入深,一起探討。通過(guò)盲法,我們來(lái)看看非盲到底是什么?

盲法是臨床試驗(yàn)非常有效的控制偏倚手段。
根據(jù)設(shè)盲程度,臨床試驗(yàn)通常分為單盲、雙盲以及開放性等設(shè)計(jì)的臨床試驗(yàn),雙盲臨床試驗(yàn)則又分為單模擬或雙模擬臨床試驗(yàn)。通過(guò)模擬試驗(yàn)藥或者對(duì)照藥的方式,可以確保雙盲試驗(yàn)的設(shè)計(jì)和執(zhí)行。
但近年來(lái)隨著國(guó)內(nèi)外越來(lái)越多創(chuàng)新藥和生物藥的多樣性,導(dǎo)致開展臨床試驗(yàn)的過(guò)程中,無(wú)法提供外觀一致的模擬產(chǎn)品,因此在臨床試驗(yàn)的過(guò)程中,因?yàn)楫a(chǎn)品外觀不同極大增加破盲的風(fēng)險(xiǎn),甚至導(dǎo)致整個(gè)臨床試驗(yàn)的失敗。
為了避免上述情況的發(fā)生,“非盲”由此而來(lái)。
對(duì)于無(wú)法提供模擬產(chǎn)品的臨床試驗(yàn),為了確保盲法的設(shè)計(jì)和執(zhí)行,也就是保證受試者、研究者以及與臨床試驗(yàn)有關(guān)的申辦方人員保持盲態(tài),臨床試驗(yàn)可以單獨(dú)設(shè)立一個(gè)非盲態(tài)的研究團(tuán)隊(duì),所有需要接觸到隨機(jī)分組信息且不接觸受試者或不參與評(píng)價(jià)的研究人員均應(yīng)是非盲研究人員,如負(fù)責(zé)藥品管理的藥品管理員和配置藥品的護(hù)士。
相對(duì)非盲態(tài)的研究團(tuán)隊(duì),盲態(tài)研究團(tuán)隊(duì)?wèi)?yīng)包含參與受試者篩選、隨訪、重點(diǎn)和安全性評(píng)價(jià)的研究人員,及所有可能接觸到受試者的研究人員,比如負(fù)責(zé)輸注藥品的護(hù)士等。
整個(gè)試驗(yàn)過(guò)程中,非盲研究人員不得將任何涉及藥品分組的任何信息和文件,透露給處于盲態(tài)的任何人員、受試者和申辦方。任何有關(guān)藥品分組的相關(guān)文件,均應(yīng)由授權(quán)的非盲研究人員單獨(dú)保存,無(wú)關(guān)人員不得隨意接觸。
“有了獨(dú)立的非盲研究團(tuán)隊(duì),既能很好按照方案設(shè)計(jì)執(zhí)行,也不會(huì)增加破盲風(fēng)險(xiǎn)。”

基于研究團(tuán)隊(duì)的區(qū)別,應(yīng)該分別設(shè)置對(duì)應(yīng)的監(jiān)查團(tuán)隊(duì),即盲態(tài)監(jiān)查團(tuán)隊(duì)和非盲監(jiān)查團(tuán)隊(duì)。
(1)非盲監(jiān)查團(tuán)隊(duì)主要負(fù)責(zé)整個(gè)試驗(yàn)盲態(tài)管理,包括藥品、非盲研究人員等方面的管理。
(2)盲態(tài)監(jiān)查團(tuán)隊(duì)則負(fù)責(zé)整個(gè)臨床試驗(yàn)的其他部分。
具體的職責(zé)劃分詳見(jiàn)下述表格:
| 盲態(tài)研究團(tuán)隊(duì) | 非研究團(tuán)隊(duì) | |
|---|---|---|
| 主要職責(zé) | 招募受試者、獲取知情同意、體格檢查、實(shí)驗(yàn)室檢查、評(píng)估受試者合格性、隨機(jī)、開具處方或醫(yī)囑、受試者隨訪、生命體征測(cè)量、評(píng)估不良事件和其他安全性數(shù)據(jù)、報(bào)告嚴(yán)重不良事件、量表評(píng)估、進(jìn)行安全性和有效性評(píng)價(jià)、數(shù)據(jù)疑問(wèn)解決、受試者管理、研究者文件夾管理等。 | 保持盲態(tài),保證整個(gè)臨床試驗(yàn)過(guò)程中盲態(tài)人員不被接觸試驗(yàn)用藥品和導(dǎo)致破盲的信息和文件。 |
| 藥品管理相關(guān)職責(zé) |
1、研究藥品輸注,觀測(cè)輸注情況; 2、提供醫(yī)療護(hù)理; 3、填寫輸注記錄表; 4、記錄輸注過(guò)程和輸注后的不良事件。 |
1、研究藥品管理:包括藥品申請(qǐng)、接受、儲(chǔ)存、分發(fā)、轉(zhuǎn)運(yùn)、配置、回收、銷毀等過(guò)程; 2、核對(duì)收集盲態(tài)研究者開具的處方; 3、填寫藥品管理過(guò)程相關(guān)表格; 4、藥品供應(yīng)管理系統(tǒng)的使用; 5、處理超溫及其他溫度背離事件; 6、非盲藥品文件夾管理。 |
為了更好的管理非盲研究團(tuán)隊(duì),確保在臨床試驗(yàn)實(shí)際操作過(guò)程中保持盲態(tài),約定臨床試驗(yàn)各個(gè)流程規(guī)范操作,那么針對(duì)非盲研究團(tuán)隊(duì),制定“盲態(tài)保持計(jì)劃”是非常緊急且重要的。
這個(gè)計(jì)劃主要需包含以下內(nèi)容:
1、盲態(tài)和非盲態(tài)研究人員分工職責(zé);
2、研究藥品管理流程(從申請(qǐng)到回收/銷毀全過(guò)程);
3、非盲文件管理要求和流程;
4、盲態(tài)和非盲態(tài)溝通管理要求和流程。
“盲態(tài)保持計(jì)劃”明確闡述盲態(tài)人員和非盲人員各自職責(zé),詳細(xì)描述在研究過(guò)程中保持盲態(tài)所采取的具體措施,保證非盲人員在藥品管理管理和配置過(guò)程中嚴(yán)格遵守盲態(tài)保持計(jì)劃的相關(guān)規(guī)定,避免意外揭盲破盲。

因試驗(yàn)周期長(zhǎng)且試驗(yàn)過(guò)程中各種因素的不確定性,需不斷更新和升級(jí)盲態(tài)保持計(jì)劃的內(nèi)容,每次更新與升級(jí)都需對(duì)所有授權(quán)的非盲以及盲態(tài)人員進(jìn)行培訓(xùn),確保其知曉具體內(nèi)容的變更,以便更好的維持盲態(tài)。
盲態(tài)保持計(jì)劃是針對(duì)試驗(yàn)本身整體的計(jì)劃,不涉及具體破盲的信息,因此不能遺漏對(duì)于盲態(tài)人員的培訓(xùn)。如果臨床試驗(yàn)過(guò)程中,中心流程已變更但盲態(tài)保持計(jì)劃卻未及時(shí)更新,那么將會(huì)導(dǎo)致非盲研究人員操作不一致,藥品管理相關(guān)文件填寫錯(cuò)誤,增加破盲風(fēng)險(xiǎn)。盲態(tài)保持計(jì)劃不止是一份流程文件,需所有授權(quán)人員統(tǒng)一執(zhí)行,相信一份好的計(jì)劃,往往會(huì)事半功倍。
“其實(shí)臨床試驗(yàn)中非盲研究團(tuán)隊(duì)和盲態(tài)研究團(tuán)隊(duì)的工作是相輔相成的,為了保證項(xiàng)目質(zhì)量,兩個(gè)團(tuán)隊(duì)缺一不可。”
以上內(nèi)容來(lái)源于臨研圈-Lily0708,上述僅限經(jīng)驗(yàn)分享,把這些寫出來(lái)只是給大家多一點(diǎn)思考的方向和辦法,如果有不贊同的地方,也期待和大家討論~

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

大多數(shù)剛畢業(yè)的同學(xué)在準(zhǔn)備進(jìn)入臨研圈的時(shí)候,一定會(huì)被鋪天蓋地的行業(yè)專有名詞搞得暈頭轉(zhuǎn)向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請(qǐng)問(wèn)貴司CEO接受應(yīng)屆生嗎?

盲法試驗(yàn)常用的有兩種:?jiǎn)蚊ぃ╯ingle blinding)和雙盲(double blinding),更嚴(yán)格的對(duì)照試驗(yàn)要用到三盲(triple blinding),在對(duì)照藥物和試驗(yàn)藥物劑型或外觀不同時(shí),還要用到雙盲雙模擬技

前面文章介紹過(guò)復(fù)腫的SSU立項(xiàng)流程,立項(xiàng)通過(guò)以后就可以進(jìn)行下面三步了,分別是:倫理審查申請(qǐng),遺傳辦申請(qǐng)(如需),合同審查申請(qǐng)。在復(fù)腫的伊柯夫網(wǎng)站上,立項(xiàng)通過(guò)后,這三步

因?yàn)镾SU階段,有好多細(xì)節(jié)機(jī)構(gòu)的官網(wǎng)上不會(huì)告訴你,你也不可能遇到不懂的問(wèn)題就去問(wèn)你的研究護(hù)士,因?yàn)樗齻內(nèi)司稚蠋资畟€(gè)項(xiàng)目,很容易被問(wèn)得沒(méi)有耐心,這也是我想把一點(diǎn)經(jīng)驗(yàn)記

剛接觸CRO行業(yè)的小伙伴,在學(xué)習(xí)文件法規(guī)資料的同時(shí),常看到一些英文類專業(yè)名詞不知道是什么意思。下面,一起看看常見(jiàn)的臨床試驗(yàn)專業(yè)術(shù)語(yǔ): CRO行業(yè)的常用術(shù)語(yǔ)解釋: 1:新藥研發(fā)

SSU是Study Start Up的縮寫,從最初的項(xiàng)目準(zhǔn)備,到啟動(dòng)訪視(Site Initiation Visit)之前所有的準(zhǔn)備工作,對(duì)整個(gè)臨床研究項(xiàng)目的啟動(dòng)非常關(guān)鍵。負(fù)責(zé)這個(gè)關(guān)鍵階段工作的部門人員,就叫做SS
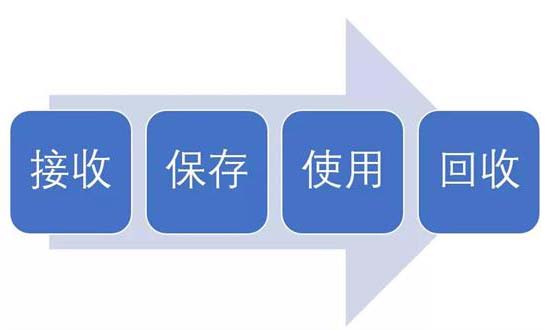
試驗(yàn)用藥品是指用于臨床試驗(yàn)的試驗(yàn)藥物、對(duì)照藥品。試驗(yàn)用藥品滲透到了臨床試驗(yàn)過(guò)程中的每一個(gè)步驟,包括藥物的生產(chǎn)、包裝、運(yùn)輸、保存、使用、回收等。今天我們從臨床試驗(yàn)中

不少二三類需要臨床的產(chǎn)品,客戶一聽(tīng)到臨床報(bào)價(jià)就退縮。既然這么貴,還不如自己做......事實(shí)真的是這樣嗎?臨床報(bào)價(jià)費(fèi)用都由哪些組成?費(fèi)用都誰(shuí)收走了?自己做又有哪些風(fēng)險(xiǎn)?文

俗話說(shuō)“知己知彼,百戰(zhàn)不殆”,對(duì)于作為CRC的我們,自認(rèn)為對(duì)CRA其實(shí)已經(jīng)很了解了,但是在我們工作過(guò)程有一個(gè)角色平時(shí)接觸不到,但是卻又繞不開躲不過(guò),尤其是面對(duì)滿屏EDC query的

大多數(shù)CRO公司在臨床試驗(yàn)現(xiàn)場(chǎng)啟動(dòng)會(huì)(SIV)上,常由CRA主導(dǎo)。作為一名有上進(jìn)心的CRA必須清楚的了解到臨床試驗(yàn)現(xiàn)場(chǎng)啟動(dòng)考察的流程,再分享一些本人在啟動(dòng)會(huì)考察的細(xì)節(jié),請(qǐng)看下文。
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問(wèn)題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
