長江三角洲區(qū)域醫(yī)療器械注冊人制度試點(diǎn)工作實(shí)施方案(試行)(滬藥監(jiān)械管〔2019〕112號)
為深入貫徹落實(shí)中共中央辦公廳、國務(wù)院辦公廳印發(fā)的《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),按照國家藥品監(jiān)督管理局《關(guān)于擴(kuò)大醫(yī)療器械


注冊備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2020-06-17 閱讀量:次
附件:熱敷貼(袋)產(chǎn)品注冊技術(shù)審查指導(dǎo)原則(2020年第39號).doc
本指導(dǎo)原則旨在為申請人進(jìn)行熱敷貼(袋)產(chǎn)品注冊申報(bào)提供技術(shù)指導(dǎo),同時也為藥品監(jiān)督管理部門對注冊申報(bào)資料的審評提供技術(shù)參考。
本指導(dǎo)原則系對熱敷貼(袋)產(chǎn)品的一般要求,申請人在參考本指導(dǎo)原則準(zhǔn)備注冊申報(bào)資料時,應(yīng)依據(jù)自身產(chǎn)品的具體特性對申報(bào)資料進(jìn)行充實(shí)和細(xì)化,若認(rèn)為產(chǎn)品不適用于相關(guān)條款和內(nèi)容,應(yīng)具體說明理由,并提供相應(yīng)的科學(xué)依據(jù)。
本指導(dǎo)原則是對申請人和審評人員的技術(shù)指導(dǎo)性文件,不作為法規(guī)強(qiáng)制執(zhí)行,亦不包括注冊審批涉及的行政事項(xiàng)。如果有能滿足相關(guān)法規(guī)要求的其他方法,也可以采用,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則。申請人和審評人員應(yīng)密切關(guān)注涉及產(chǎn)品的法規(guī)變化情況,及時對產(chǎn)品進(jìn)行更新和變化,以保證申報(bào)產(chǎn)品符合國家最新的法規(guī)要求。
本指導(dǎo)原則所編制的核心內(nèi)容是在目前的科技認(rèn)識水平、法規(guī)要求、標(biāo)準(zhǔn)體系和產(chǎn)品現(xiàn)狀的基礎(chǔ)上編制完成的,隨著科學(xué)技術(shù)的不斷發(fā)展、法規(guī)的更新和相關(guān)標(biāo)準(zhǔn)的不斷完善,本指導(dǎo)原則的相關(guān)內(nèi)容也將會進(jìn)行適當(dāng)?shù)恼{(diào)整。
本指導(dǎo)原則適用于:
YY 0060-2018《熱敷貼(袋)》(注:本指導(dǎo)原則中標(biāo)準(zhǔn)適用于最新版本,下同。)所規(guī)定的將主要材料成份(鐵粉、水、活性炭、食鹽等,且不含任何藥物成分),按一定比例放入內(nèi)袋密封,利用鐵粉氧化的升溫致熱原理,通過熱傳導(dǎo)作用方式對患者進(jìn)行輔助治療的貼敷類產(chǎn)品。
多功能敷貼類產(chǎn)品(如具有磁療、遠(yuǎn)紅外等功能)的熱敷貼(袋)部分,應(yīng)適用于本指導(dǎo)原則。
不適用于:
含有化學(xué)成分、中藥材(或天然植物)及其提取物等,所含成分發(fā)揮藥理學(xué)、免疫學(xué)或者代謝作用的貼敷類產(chǎn)品;
含有化學(xué)成分、中藥材(或天然植物)及其提取物等,不能證明不發(fā)揮藥理學(xué)、免疫學(xué)或者代謝作用的貼敷類產(chǎn)品。
(一)產(chǎn)品名稱要求
在《關(guān)于發(fā)布醫(yī)療器械分類目錄的公告》(國家食品藥品監(jiān)督管理總局公告2017年第104號)中,熱敷貼(袋)的管理類別為二類,
產(chǎn)品分類編碼為09-02-01。
產(chǎn)品名稱應(yīng)為通用名稱,并符合《醫(yī)療器械通用名稱命名規(guī)則》(國家食品藥品監(jiān)督管理總局令第19號)等相關(guān)法規(guī)、規(guī)范性文件的要求。核心詞為“熱敷貼(袋)”,特征詞1產(chǎn)品作用方式(指產(chǎn)品與人體接觸方式),如直接接觸皮膚產(chǎn)品為接觸式,不直接接觸皮膚產(chǎn)品為非接觸式等,特征詞2產(chǎn)品結(jié)構(gòu)特點(diǎn)(產(chǎn)品主體結(jié)構(gòu)方面的特有屬性),如粘貼式和非粘貼式等;特征詞3按產(chǎn)品使用部位(指產(chǎn)品發(fā)揮其主要功能的患者部位),如關(guān)節(jié)和頸椎等。
(二)產(chǎn)品的結(jié)構(gòu)和組成
熱敷貼(袋)是一種外用敷貼,為局部使用產(chǎn)品,鐵粉與空氣中的氧氣發(fā)生氧化反應(yīng)致熱的發(fā)熱產(chǎn)品,一般為一次性使用。按使用方式可分為粘貼式和非粘貼式,按與人體接觸方式可分為直接接觸皮膚式和非直接接觸皮膚式。
熱敷貼(袋)一般由無紡布層(或其他醫(yī)用材料)、透氣層、發(fā)熱料層(以鐵粉、水、活性炭、食鹽等為原料)、粘貼層(醫(yī)用膠帶/壓敏膠層)和防粘隔離層(硅油紙、離型紙/膜)及外袋組成。
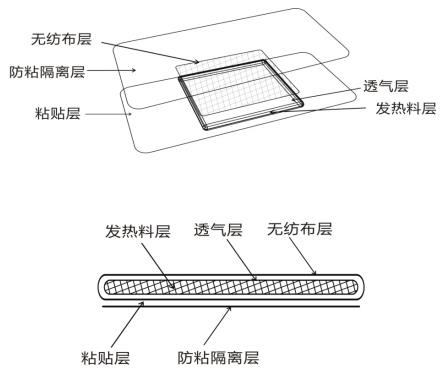
圖1-常見的粘貼式結(jié)構(gòu)示意圖
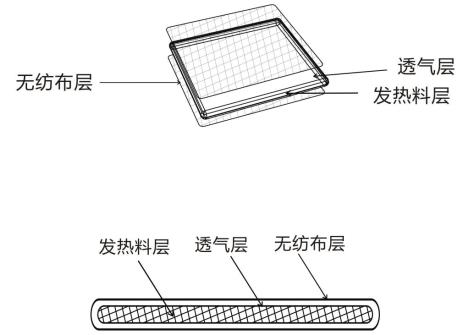
圖2-常見的非粘貼式結(jié)構(gòu)示意圖
1.外袋
熱敷貼(袋)由于其發(fā)熱原理,在貯存時需隔絕空氣,因此,需要具有密封性能的外包裝袋或外包裝真空袋來保證包裝的氣密性,即阻隔空氣中的氧氣,防止發(fā)熱包中水分蒸發(fā)。
2.無紡布層
熱敷貼(袋)放熱過程中控制放熱時間和溫度是通過透氣膜透氧率進(jìn)行控制的,而透氣膜較薄、易破損,覆蓋一層無紡布可以防止透氣膜磨損,又因其柔軟特性,使用時舒適度較高。
3.透氣層
熱敷貼(袋)放熱過程中控制溫度和放熱時間是通過透氣膜透氧率進(jìn)行控制的。如果透氧率過高,發(fā)熱包釋放的熱量比較集中,會導(dǎo)致溫度過高而燙傷皮膚,且持續(xù)放熱時間較短。如果透氧率過低,會導(dǎo)致溫度過低,無法達(dá)到輔助治療目的。
4.發(fā)熱料層
以鐵粉、水、活性炭、食鹽等原料混合而成,是熱敷貼的核心組成部分。其發(fā)熱時間和發(fā)熱溫度除與氧氣透過率有關(guān),還與該發(fā)熱料層的原料配比有關(guān)。另外鐵粉的純度及粗細(xì)都會直接影響溫度特性。
5.粘貼層
使熱敷貼(袋)可以直接固定于皮膚或者衣物上。一般由壓敏膠和背襯組成,常用醫(yī)用膠帶。
6.防粘隔離層
使熱敷貼(袋)在使用前保持粘性,方便使用。
以上列舉了熱敷貼(袋)的一般結(jié)構(gòu)組成,部分產(chǎn)品發(fā)熱料層中含有保溫材料(如蛭石),保水材料(如吸水樹脂)等,部分產(chǎn)品含有緩釋熱墊,申請人應(yīng)詳述各組成部分的材料。產(chǎn)品內(nèi)袋一般由無紡布層、透氣層和粘貼層組成,申請人應(yīng)明確內(nèi)袋、外袋和粘貼層的材質(zhì)和物理尺寸,必要時,可配示意圖。申報(bào)時需提供產(chǎn)品各組成部分的清晰圖片。
(三)產(chǎn)品工作原理/作用機(jī)理
1.工作原理
主要材料(鐵粉、水、活性炭、食鹽等,且不含任何藥物成分),按一定比例放入內(nèi)袋密封,鐵粉接觸空氣中的氧氣,在鹽和水作用下發(fā)生化學(xué)反應(yīng)產(chǎn)生熱量。
2.作用機(jī)理
熱效應(yīng)是熱敷貼(袋)產(chǎn)品的主要作用機(jī)理,其治療作用為在體表特定部位進(jìn)行熱傳導(dǎo),使局部溫度升高,擴(kuò)張血管,促進(jìn)局部血液循環(huán)。
(四)注冊單元劃分的原則和實(shí)例
熱敷貼(袋)的注冊單元原則上以功能、性能指標(biāo)和預(yù)期用途為劃分依據(jù)。
1.產(chǎn)品的功能不同應(yīng)作為不同注冊單元進(jìn)行注冊。
如:多功能敷貼類產(chǎn)品和單一功能敷貼類產(chǎn)品,由于功能、性能指標(biāo)和預(yù)期用途均不相同,應(yīng)作為不同注冊單元。
2.產(chǎn)品溫度特性的最高溫度和持續(xù)時間不同應(yīng)作為不同注冊單元進(jìn)行注冊。
如:直接與人體皮膚接觸和不直接接觸產(chǎn)品最高溫度不同,材料的生物學(xué)評價要求不同,應(yīng)作為不同注冊單元。
(五)產(chǎn)品適用相關(guān)標(biāo)準(zhǔn)
熱敷貼(袋)產(chǎn)品適用的標(biāo)準(zhǔn)見表1。
表1 相關(guān)產(chǎn)品標(biāo)準(zhǔn)
| 標(biāo)準(zhǔn)編號 | 標(biāo)準(zhǔn)名稱 |
| GB/T 191—2008 | 包裝儲運(yùn)圖示標(biāo)志 |
| GB/T 16886.1—2011 | 醫(yī)療器械生物學(xué)評價第1部分:風(fēng)險(xiǎn)管理過程中的評價與試驗(yàn) |
| GB/T 16886.5—2017 | 醫(yī)療器械生物學(xué)評價第5部分:體外細(xì)胞毒性試驗(yàn) |
| GB/T 16886.10—2017 | 醫(yī)療器械生物學(xué)評價第10部分:刺激與遲發(fā)型超敏反應(yīng)試驗(yàn) |
| YY 0060—2018 | 熱敷貼(袋) |
| YY/T 0148—2006 | 醫(yī)用膠帶通用要求 |
| YY/T 0287—2017 | 醫(yī)療器械質(zhì)量管理體系用于法規(guī)的要求 |
| YY/T 0316—2016 | 醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用 |
上述標(biāo)準(zhǔn)包括了產(chǎn)品技術(shù)要求中涉及到的標(biāo)準(zhǔn)。有的注冊申請人還會根據(jù)產(chǎn)品的特點(diǎn)引用一些行業(yè)外的標(biāo)準(zhǔn)和一些較為特殊的標(biāo)準(zhǔn)。
產(chǎn)品適用及引用標(biāo)準(zhǔn)的審查可以分兩步來進(jìn)行。首先對引用標(biāo)準(zhǔn)的齊全性和適宜性進(jìn)行審查,也就是在編寫注冊產(chǎn)品技術(shù)要求時是否引用了與產(chǎn)品相關(guān)的國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn),以及引用是否準(zhǔn)確。其次對引用標(biāo)準(zhǔn)的采納情況進(jìn)行審查。即所引用的標(biāo)準(zhǔn)中的條款要求,是否在注冊產(chǎn)品技術(shù)要求中進(jìn)行了實(shí)質(zhì)性的條款引用。這種引用通常采用兩種方式,文字表述繁多內(nèi)容復(fù)雜的可以直接引用標(biāo)準(zhǔn)及條文號,比較簡單的也可以直接引述具體要求。
如有新版強(qiáng)制性國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)發(fā)布實(shí)施,產(chǎn)品性能指標(biāo)等要求應(yīng)執(zhí)行最新版本的國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)。
(六)產(chǎn)品的適用范圍/預(yù)期用途
1.適用范圍:用于促進(jìn)局部血液循環(huán)和組織代謝,有助于消散水腫,抑制炎癥,緩解肌肉緊張所致的疼痛。
2.預(yù)期使用環(huán)境:無特殊要求,避免在易引起熱敷貼(袋)溫度過高的環(huán)境使用,如:高壓氧艙、電熱器具附近。
3.適用人群:應(yīng)明確患者人群的信息,如患者年齡范圍等。患有惡性腫瘤者、佩戴心臟起搏器者、合并有心腦血管、肝、肺、腎和造血系統(tǒng)等嚴(yán)重原發(fā)性疾病者;精神病患者;孕婦及哺乳期婦女;體質(zhì)極度虛弱者、兒童及對溫度變化不太敏感的患者使用應(yīng)遵醫(yī)囑。
4.禁忌癥:包括不限于皮膚破損、潰爛、感覺障礙、急性閉合性損傷、化膿性感染及急性期炎癥患者,惡性腫瘤、活動性結(jié)核、精神類患者,皮膚病、嚴(yán)重糖尿病、高熱患者及對產(chǎn)品材質(zhì)過敏者。
(七)產(chǎn)品的主要風(fēng)險(xiǎn)
1.風(fēng)險(xiǎn)分析方法
(1)在對風(fēng)險(xiǎn)的判定及分析中,要考慮合理的可預(yù)見的情況,它們包括:正常使用條件下和非正常使用條件下;
(2)風(fēng)險(xiǎn)判定及分析應(yīng)包括:對于患者的危害、對于操作者的危害和對于環(huán)境的危害;
(3)風(fēng)險(xiǎn)形成的初始原因應(yīng)包括:原材料選擇不當(dāng),設(shè)計(jì)、生產(chǎn)風(fēng)險(xiǎn),運(yùn)輸與防護(hù)不當(dāng)?shù)龋蝗藶橐蛩匕ú缓侠淼牟僮鳎贿m用錯誤;綜合危害;環(huán)境條件;
(4)風(fēng)險(xiǎn)判定及分析考慮的問題包括:產(chǎn)品原材料生物學(xué)危害;產(chǎn)品質(zhì)量是否會導(dǎo)致使用中出現(xiàn)不正常結(jié)果;操作信息,包括警示性語言、注意事項(xiàng)以及使用方法的準(zhǔn)確性等。
2.風(fēng)險(xiǎn)分析清單
熱敷貼(袋)產(chǎn)品的風(fēng)險(xiǎn)管理報(bào)告應(yīng)符合YY/T0316—2016《醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用》的有關(guān)要求,審查要點(diǎn)包括:
(1)產(chǎn)品定性定量分析是否準(zhǔn)確(依據(jù)YY/T0316—2016 附錄A);
(2)危害分析是否全面(依據(jù)YY/T0316—2016附錄D);
(3)風(fēng)險(xiǎn)可接受準(zhǔn)則,降低風(fēng)險(xiǎn)的措施及采取措施后風(fēng)險(xiǎn)的可接受程度,是否有新的風(fēng)險(xiǎn)產(chǎn)生。根據(jù)YY/T0316—2016《醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用》附錄E危險(xiǎn)(源)、可預(yù)見的事件序列和危險(xiǎn)情況示例對“熱敷貼(袋)”已知或可預(yù)見的風(fēng)險(xiǎn)進(jìn)行判定,產(chǎn)品在進(jìn)行風(fēng)險(xiǎn)分析時至少應(yīng)包括以下的主要危害(見表1),注冊申請人還應(yīng)根據(jù)自身產(chǎn)品特點(diǎn)確定其他危害。針對產(chǎn)品的各項(xiàng)風(fēng)險(xiǎn),注冊申請人應(yīng)采取應(yīng)對措施,確保風(fēng)險(xiǎn)降到可接受的程度。
表1 產(chǎn)品主要危害
| 危險(xiǎn)(源) | 可預(yù)見的事件 序列 | 危險(xiǎn)情況 | 可發(fā)生的 傷害 | |
| 生物學(xué)危害 | 生物相容性 | 與皮膚接觸的材料生物不相容 | 生物不相容的材料接觸患者皮膚 | 引起患者水腫和紅腫等過敏 |
| 能量危害 | 熱能 | 產(chǎn)品的發(fā)熱材料存在缺陷,如配方配比存在問題 | 產(chǎn)品最高溫度過高 | 患者被燙傷 |
| 扭轉(zhuǎn)力、剪切力和張力 | 使用過程中產(chǎn)品撕裂損壞 | (1)造成產(chǎn)品無法正常使用 (2)造成主要原料(如鐵粉)外泄 | 功能性、使用性喪失 引起患者過敏 | |
| 操作危害 | 功能喪失或降低 | 產(chǎn)品的發(fā)熱材料存在缺陷,如配方配比存在問題 | 發(fā)熱持續(xù)時間不足 | 產(chǎn)品無法達(dá)到預(yù)期療效 |
| 粘貼性能存在問題(粘貼式) | 粘貼不牢易脫落 不能持續(xù)粘貼在需治療部位 | 產(chǎn)品無法達(dá)到預(yù)期療效 | ||
| 剝離強(qiáng)度太大(粘貼式) | 剝離強(qiáng)度過大、使用后難以剝離 | 剝離過程損傷患者皮膚 | ||
| 環(huán)境危害 | 運(yùn)輸和儲存環(huán)境不當(dāng) | 儲運(yùn)過程中發(fā)生機(jī)械性破壞 | (1)產(chǎn)品損壞 (2)產(chǎn)品非正常發(fā)熱 | 功能性、使用性喪失 |
| 儲存或運(yùn)輸條件偏離預(yù)定的環(huán)境條件(如溫度、濕度)。 | (1)產(chǎn)品非正常老化 (2)過高濕度造成產(chǎn)品提前發(fā)熱 | 功能性、使用性喪失 | ||
| 信息危害 | 信息不恰當(dāng)或不完整 | 不適當(dāng)?shù)念A(yù)期使用規(guī)范 | 產(chǎn)品使用不適當(dāng) | 功能性、使用性喪失 低溫灼傷 |
| 說明書上的注意事項(xiàng)不全,如沒提供使用后的處理信息 | 產(chǎn)品使用后處置不當(dāng) | 破壞環(huán)境 | ||
| 限制未充分公示 | 對一次性使用醫(yī)療器械很可能再次使用的危害警告不適當(dāng)或缺失 | 重復(fù)使用 | 功能性、使用性喪失 引起感染 交叉感染 對人體產(chǎn)生副作用或引發(fā)其他傷害 | |
| 未提供使用期限信息 | 超期使用 | 產(chǎn)品無法達(dá)到預(yù)期療效 | ||
(八)產(chǎn)品的研究要求
1.產(chǎn)品性能研究
應(yīng)給出技術(shù)要求(包括規(guī)格參數(shù)和性能要求)中各性能指標(biāo)的設(shè)定依據(jù)、所采用的標(biāo)準(zhǔn)或方法、采用的原因及理論基礎(chǔ)。
熱敷貼(袋)的性能研究可參照YY0060—2018《熱敷貼(袋)》。若適用的國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)中有不采納或偏離的條款,應(yīng)說明不適用的理由。
2.生物相容性評價
與人體直接接觸的,應(yīng)按照《關(guān)于印發(fā)醫(yī)療器械生物學(xué)評價和審查指南的通知》(國食藥監(jiān)械〔2007〕345號)提交生物學(xué)評價報(bào)告。
生物相容性評價應(yīng)根據(jù)預(yù)期用途明確熱敷貼(袋)預(yù)期與人體接觸的部位、接觸性質(zhì)、接觸時間以及所采用的材料的種類。根據(jù)接觸性質(zhì)、接觸時間、材料的種類等信息選擇合適的評價方式開展評價研究。
如需進(jìn)行生物相容性試驗(yàn),應(yīng)按照GB/T16886系列標(biāo)準(zhǔn)的要求開展。并注意:
(1)生物相容性評價應(yīng)對成品中預(yù)期與人體接觸的部分進(jìn)行評價。
(2)研究資料中的生物學(xué)試驗(yàn)報(bào)告可提供境內(nèi)檢驗(yàn)報(bào)告或境外檢驗(yàn)報(bào)告,檢驗(yàn)報(bào)告中應(yīng)包括樣品制備方法、試驗(yàn)方法及試驗(yàn)結(jié)果。境外報(bào)告需提供國外實(shí)驗(yàn)室表明其符合GLP實(shí)驗(yàn)室要求的質(zhì)量保證文件。
3.滅菌/消毒工藝研究
熱敷貼(袋)通常為一次性使用非無菌提供的產(chǎn)品,不涉及滅菌/消毒工藝。
4.產(chǎn)品有效期和包裝研究
熱敷貼(袋)產(chǎn)品應(yīng)提供有效期驗(yàn)證報(bào)告。熱敷貼(袋)類產(chǎn)品有效期屬于貨架有效期,驗(yàn)證類型通常可分為加速穩(wěn)定性試驗(yàn)或?qū)崟r穩(wěn)定性試驗(yàn)兩類,試驗(yàn)后產(chǎn)品的使用性能仍符合產(chǎn)品技術(shù)要求。
熱敷貼(袋)的包裝應(yīng)該能夠保護(hù)其免受不利的儲存和運(yùn)輸條件影響所造成的損害。對于熱敷貼(袋)類產(chǎn)品,主要是從發(fā)熱材料和封裝材料的保護(hù)角度出發(fā),目的是保障其使用性能。應(yīng)提供包裝的信息,包括不限于包裝材料、包裝尺寸、包裝方式、包裝封口工藝等,可通過圖示說明。
包裝及包裝完整性:產(chǎn)品包裝應(yīng)進(jìn)行完整性測試,并提供運(yùn)輸過程和存儲環(huán)境對產(chǎn)品產(chǎn)生影響的驗(yàn)證資料。
(九)產(chǎn)品技術(shù)要求的主要性能指標(biāo)
1. 產(chǎn)品型號/規(guī)格及其劃分說明
1.1型號規(guī)格
1.2劃分說明
1.3材料組成
1.4材料要求
明確型號規(guī)格及劃分依據(jù)。對于有多種型號的情況,必要時,可列表和/或提供圖示說明各型號之間的異同。
2. 性能要求
熱敷貼(袋)產(chǎn)品應(yīng)至少包含以下技術(shù)指標(biāo)的要求,注冊申請人可根據(jù)自身產(chǎn)品的技術(shù)特點(diǎn)制定相應(yīng)的產(chǎn)品技術(shù)要求,但不得低于相關(guān)強(qiáng)制性國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)的有關(guān)要求。主要性能指標(biāo)如下:
2.1尺寸
內(nèi)袋及粘貼面尺寸應(yīng)符合制造商的規(guī)定,允差±10%。
2.2外觀
熱敷貼(袋)的內(nèi)、外袋包裝整齊,不準(zhǔn)許破裂;印刷清晰,不得脫落。
2.3外包裝的密閉性
將包裝完整的熱敷貼(袋)沉入水中,減壓1min,不準(zhǔn)許有氣泡連續(xù)產(chǎn)生。試驗(yàn)后內(nèi)部應(yīng)無試驗(yàn)用水滲入。
2.4內(nèi)袋抗跌落
內(nèi)袋置于1.5m高處,使其自由落下到地面上10次,不得開裂。
2.5包裝袋拉張強(qiáng)度
-2.5.1內(nèi)袋強(qiáng)度
非粘貼內(nèi)袋:橫向、縱向在100N拉力下,不準(zhǔn)許出現(xiàn)破損。
粘貼內(nèi)袋:橫向、縱向在50N拉力下,不準(zhǔn)許出現(xiàn)破損。
-2.5.2外袋強(qiáng)度
橫向、縱向在30N拉力下,不準(zhǔn)許出現(xiàn)破損。
-2.5.3外袋材料的氣密性
外袋的透濕性:水蒸氣透過率≤4.0g/(m2·24h)。
外袋的透氧性:氧氣透過量≤12cm3/(m2·24h·0.1MPa)[相當(dāng)于6.1×10-14mol/(m2·s·Pa)]。
2.6粘貼性能
粘貼式熱敷貼(袋)的粘貼部分應(yīng)有良好的持粘性,在溫度特性測試試驗(yàn)后不得有脫落現(xiàn)象。
2.7剝離強(qiáng)度(與皮膚直接接觸產(chǎn)品適用)
粘貼式產(chǎn)品制造商應(yīng)規(guī)定剝離強(qiáng)度的相關(guān)要求。
2.8溫度特性
溫度特性應(yīng)使用YY 0060-2018《熱敷貼(袋)》附錄A規(guī)定的溫度試驗(yàn)方法進(jìn)行試驗(yàn)。
2.8.1最高溫度
制造商應(yīng)規(guī)定熱敷貼(袋)的最高溫度,允差±5℃,且直接與人體皮膚接觸的熱敷貼(袋)的最高溫度應(yīng)不大于60℃;不直接與人體皮膚接觸的熱敷貼(袋)的最高溫度應(yīng)不大于70℃。
2.8.2升溫時間
熱敷貼(袋)的升溫時間應(yīng)≤20min。
2.8.3持續(xù)時間
熱敷貼(袋)的持續(xù)時間應(yīng)不小于制造商的規(guī)定。
2.8.4溫度保證時間
熱敷貼(袋)的溫度保證時間應(yīng)≥持續(xù)時間的50%。
2.9有效期及臨近效期產(chǎn)品的溫度性能
制造商應(yīng)規(guī)定出產(chǎn)品的有效期,臨近效期產(chǎn)品的溫度特性應(yīng)滿足相關(guān)要求。
(十)同一注冊單元內(nèi)注冊檢驗(yàn)典型性產(chǎn)品確定原則和實(shí)例
如選擇典型性型號進(jìn)行檢測,應(yīng)提交典型性聲明,從技術(shù)角度明確選擇典型性型號的依據(jù)。所選產(chǎn)品應(yīng)能代表全部申報(bào)產(chǎn)品的安全性、有效性。同一注冊單元不同型號產(chǎn)品如存在主要性能指標(biāo)差異,建議對差異部分進(jìn)行考察。
(十一)產(chǎn)品生產(chǎn)制造相關(guān)要求
1.生產(chǎn)工藝過程及過程控制點(diǎn)
注冊申請人應(yīng)根據(jù)申報(bào)產(chǎn)品的實(shí)際情況,以流程圖的形式對生產(chǎn)工藝過程進(jìn)行詳細(xì)描述,注明關(guān)鍵工序和特殊過程,并進(jìn)行簡單說明。關(guān)鍵工序和特殊過程因生產(chǎn)企業(yè)不同可能會存在差異。應(yīng)說明生產(chǎn)工藝過程質(zhì)量控制點(diǎn),包括關(guān)鍵工序和特殊過程的控制規(guī)定和方法。
2.研制、生產(chǎn)場地情況概述
應(yīng)結(jié)合場地平面圖詳細(xì)介紹研發(fā)、生產(chǎn)、檢驗(yàn)、倉庫場地情況。有多個研制、生產(chǎn)場地,應(yīng)介紹每個研制、生產(chǎn)場地的實(shí)際情況。生產(chǎn)場地應(yīng)與生產(chǎn)規(guī)模相適應(yīng)。生產(chǎn)場地的區(qū)域劃分應(yīng)與生產(chǎn)工藝流程相符合。
(十二)產(chǎn)品的臨床評價要求
根據(jù)《關(guān)于公布新修訂免于進(jìn)行臨床試驗(yàn)醫(yī)療器械目錄的通告》(國家藥品監(jiān)督管理局通告2018年第94號,以下簡稱《目錄》)的規(guī)定,熱敷貼(袋)可以豁免臨床試驗(yàn),注冊申請人需提交申報(bào)產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的對比資料和申報(bào)產(chǎn)品與已獲準(zhǔn)境內(nèi)注冊的《目錄》中醫(yī)療器械的對比說明。
(十三)產(chǎn)品的不良事件歷史記錄
制造商應(yīng)關(guān)注相關(guān)產(chǎn)品的不良事件。
目前該類產(chǎn)品常見不良事件為燙傷型皮膚水泡和皮膚紅腫、瘙癢、皮疹等過敏癥狀。
(十四)產(chǎn)品說明書和標(biāo)簽要求
產(chǎn)品說明書和標(biāo)簽的編寫應(yīng)符合《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》(國家食品藥品監(jiān)督管理總局令第6號)及熱敷貼(袋)YY0060-2018等相關(guān)標(biāo)準(zhǔn)要求。此外應(yīng)完善以下內(nèi)容:
1.應(yīng)給出使用方法、使用頻次及貼敷部位等。
2.禁忌癥及慎用人群。
2.1禁忌癥中建議包含以下內(nèi)容:
包括不限于皮膚破損、開放性傷口、潰爛、感覺障礙、急性閉合性損傷、化膿性感染及急性期炎癥患者,惡性腫瘤、活動性結(jié)核、精神類患者,皮膚病、嚴(yán)重糖尿病、高熱患者及對產(chǎn)品材質(zhì)過敏者。
2.2慎用人群建議包含以下內(nèi)容:
患有惡性腫瘤者、佩戴心臟起搏器者、合并有心腦血管、肝、肺、腎和造血系統(tǒng)等嚴(yán)重原發(fā)性疾病者;精神病患者;孕婦及哺乳期婦女;體質(zhì)極度虛弱者、兒童及對溫度變化不太敏感的患者。
3.注意事項(xiàng)、警示及提示性內(nèi)容。
注意事項(xiàng)、警示及提示性內(nèi)容建議包含(不限于)以下內(nèi)容:
3.1不直接接觸人體皮膚的產(chǎn)品,應(yīng)對隔離物材質(zhì)和厚度進(jìn)行說明;
3.2高海拔地區(qū)可能會影響產(chǎn)品使用效果,建議制造商根據(jù)研究資料給出要求;
3.3熱敷貼(袋)用于眼部時,溫度及使用時間以使用者舒適為宜。眼部有疾病患者使用遵醫(yī)囑;
3.4產(chǎn)品不能代替藥物治療;若配合藥物使用,需咨詢專業(yè)醫(yī)生。
3.5建議在清醒狀態(tài)下使用,避免劇烈運(yùn)動及睡眠中使用;
3.6使用時應(yīng)避免產(chǎn)品發(fā)生擠壓;
3.7在同一位置長時間使用,存在低溫燙傷的風(fēng)險(xiǎn)。
(一)產(chǎn)品主要材料成分中不應(yīng)出現(xiàn)磁片(磁粉)、元素層、陶瓷粉、藥物等成分。
(二)申報(bào)產(chǎn)品的規(guī)格型號是否能滿足一個注冊單元要求,申報(bào)事項(xiàng)是否準(zhǔn)確,命名是否合理。
(三)直接接觸皮膚式產(chǎn)品應(yīng)進(jìn)行生物相容性評價,并符合要求。
(四)包裝完整性研究是否包括氣密性研究,效期研究是否包括臨近效期產(chǎn)品溫度性能研究。
(五)安全風(fēng)險(xiǎn)管理報(bào)告要審查產(chǎn)品的主要風(fēng)險(xiǎn)(包括設(shè)計(jì)、原材料、加工工藝、運(yùn)輸和儲存條件及使用等方面)是否已經(jīng)列舉,控制措施是否有效,風(fēng)險(xiǎn)是否降到可接受的程度之內(nèi)。
(六)產(chǎn)品技術(shù)要求編寫的規(guī)范性,引用標(biāo)準(zhǔn)的適用性、準(zhǔn)確性,內(nèi)容是否符合YY0060—2018《熱敷貼(袋)》及有關(guān)標(biāo)準(zhǔn)的要求。
(七)檢測報(bào)告的產(chǎn)品名稱、型號、生產(chǎn)商等基本信息應(yīng)與申報(bào)一致。應(yīng)明確檢測依據(jù)和結(jié)論。性能部分應(yīng)與技術(shù)要求中性能部分的要求表述一致,安全部分應(yīng)全面引用相關(guān)強(qiáng)制性標(biāo)準(zhǔn),依據(jù)產(chǎn)品的適用性出具完整報(bào)告。
(八)產(chǎn)品適用范圍是否明確,與臨床評價結(jié)果是否符合。臨床評價選取的對比產(chǎn)品與申報(bào)產(chǎn)品在工作原理、結(jié)構(gòu)組成、性能指標(biāo)、適用范圍等是否實(shí)質(zhì)性等同。性能指標(biāo)存在差異的,應(yīng)對是否會帶來新的風(fēng)險(xiǎn)及影響預(yù)期應(yīng)用作出評價。
適用范圍在醫(yī)療器械注冊申請表、綜述資料、安全風(fēng)險(xiǎn)評價資料、產(chǎn)品使用說明書、同類型產(chǎn)品對比說明等方面的敘述是否一致。
(九)說明書中必須告知用戶的使用方法、禁忌癥、注意事項(xiàng)等信息是否完整。
牽頭單位:重慶市醫(yī)療器械技術(shù)審評認(rèn)證中心。參與單位:北京市醫(yī)療器械技術(shù)審評認(rèn)證中心、福建省食品藥品認(rèn)證審評中心

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

為深入貫徹落實(shí)中共中央辦公廳、國務(wù)院辦公廳印發(fā)的《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),按照國家藥品監(jiān)督管理局《關(guān)于擴(kuò)大醫(yī)療器械

為規(guī)范醫(yī)療器械注冊人跨區(qū)域委托生產(chǎn)的監(jiān)督管理,推進(jìn)長江三角洲區(qū)域醫(yī)療器械跨區(qū)域監(jiān)管,根據(jù)《中共中央辦公廳國務(wù)院辦公廳關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》《

附件:血液透析用水處理設(shè)備注冊審查指導(dǎo)原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設(shè)備注冊審查指導(dǎo)原則(2024年修訂版)本指導(dǎo)原則旨在指導(dǎo)注冊申請人對血液透析用水處理設(shè)備注冊申報(bào)資料的準(zhǔn)備及撰寫,同時也為技術(shù)審評部門提供參考。本指導(dǎo)原則是對血液透析用水處理設(shè)備的一般要求,注冊申請人依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用。若不適用,要具體闡述理由及相應(yīng)的科學(xué)依據(jù),并依據(jù)產(chǎn)

本指導(dǎo)原則旨在幫助和指導(dǎo)注冊申請人對一次性使用腹部穿刺器注冊申報(bào)資料進(jìn)行準(zhǔn)備,以滿足技術(shù)審評的基本要求。同時有助于審評機(jī)構(gòu)對該類產(chǎn)品進(jìn)行科學(xué)規(guī)范的審評,提高審評工

國家藥監(jiān)局關(guān)于發(fā)布免于臨床試驗(yàn)的體外診斷試劑臨床評價技術(shù)指導(dǎo)原則的通告(2021年第74號)發(fā)布時間:2021-09-24為指導(dǎo)體外診斷試劑的臨床評價工作,根據(jù)

國家藥監(jiān)局藥審中心關(guān)于發(fā)布《抗腫瘤藥物臨床試驗(yàn)中SUSAR分析與處理技術(shù)指導(dǎo)原則》的通告(2024年第42號) 發(fā)布日期:20241010

國家市場監(jiān)督管理總局令 第47號 《醫(yī)療器械注冊與備案管理辦法》已經(jīng)2021年7月22日市場監(jiān)管總局第11次局務(wù)會議通過,現(xiàn)予公布,自2021年10月1日起施行。 附件: 醫(yī)療器械注冊與備案管

國家藥監(jiān)局器審中心關(guān)于發(fā)布影像型超聲診斷設(shè)備(第三類)注冊審查指導(dǎo)原則(2023年修訂版)的通告(2024年第29號)發(fā)布時間:2024-10-14為進(jìn)一步規(guī)范

附件:醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊審查指導(dǎo)原則(2024年第21號).doc醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊審查指導(dǎo)原則本指導(dǎo)原則旨在指導(dǎo)注冊申請人準(zhǔn)備及撰寫醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊申報(bào)資料,同時也為技術(shù)審評部門審查注冊申報(bào)資料提供參考。本指導(dǎo)原則是對醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料產(chǎn)品的一般要求,注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用,若不適用,需具體闡述理由及相應(yīng)的科學(xué)依據(jù),并依據(jù)產(chǎn)品的具體特性對

附件:重組膠原蛋白創(chuàng)面敷料注冊審查指導(dǎo)原則(2023年第16號).doc重組膠原蛋白創(chuàng)面敷料注冊審查指導(dǎo)原則本指導(dǎo)原則旨在指導(dǎo)注冊申請人準(zhǔn)備及撰寫重組膠原蛋白創(chuàng)
行業(yè)資訊
知識分享
法規(guī)文件
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價
咨詢相關(guān)問題或咨詢報(bào)價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
