海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法(瓊藥監綜〔2020〕3號)
《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
附件:山東省醫療器械工藝用水現場檢查指南(魯藥監械〔2021〕35號).pdf
為規范醫療器械現場檢查,提升檢查員現場檢查能力,指導檢查員對醫療器械生產企業工藝用水控制情況的檢查,提高企業工藝用水質量安全保證水平,依據《醫療器械監督管理條例》《醫療器械生產監督管理辦法》《醫療器械生產質量管理規范》等法規、規章、標準及規范性文件制定本指南。
本指南不作為法規強制執行。本指南是在現行法規、標準體系及當前認知水平下制定的,隨著法規、標準體系的不斷完善和科學技術的不斷發展,本指南相關內容也將適時進行調整。
本指南可作為山東省藥品監督管理局組織、實施的《醫療器械生產許可證》核發、變更、延續等現場檢查、醫療器械注冊質量管理體系核查、醫療器械生產質量管理規范檢查、醫療器械生產監督檢查等各項涉及工藝用水檢查的參考,也可為醫療器械生產企業工藝用水管理提供參考。
(一)工藝用水的定義及用途
1.定義
本指南所指工藝用水是醫療器械產品實現過程中使用或接觸的水的總稱,主要包括符合《中華人民共和國藥典》規定的純化水、注射用水和滅菌注射用水,還包括體外診斷試劑用純化水、血液透析及相關治療用水、分析實驗室用水等。
1.1 純化水是指原水(通常為生活飲用水)經蒸餾法、離子交換法、反滲透法或其它適宜方法制備的水,不含任何附加劑。主要用于零部件的清洗、生產工藝用冷卻、工位器具清洗、潔凈室和工作臺面清洗、消毒液配制、內包裝清洗、作為配料水以及制備注射用水等。
1.2 注射用水是指純化水經蒸餾法所得的水,也可以是用超濾法制備的具有同等要求的水。應符合細菌內毒素實驗要求。主要用于與藥液直接接觸的零配件的末道清洗、產品配料用水、儲水器清洗、內包裝清洗等。
1.3 滅菌注射用水是指注射用水按照注射劑生產工藝制備所得的水。
1.4 其它
生活飲用水是指供人生活的飲水和生活用水,常用作純化水原水,也可能用于設備冷卻、某些零部件、工位器具清洗等。
2.用途
根據法規要求,工藝用水主要適用于無菌醫療器械、植入性醫療器械、體外診斷試劑等生產企業產品生產過程中用于產品清洗、配制、潔凈服清洗、工位器具清洗、環境清洗環節以及作為檢測試劑制備的底液等。生產企業應當結合實際生產需要選擇合適的工藝用水,同時采取適當的措施,避免或降低微生物污染。
對于需清潔處理的無菌醫療器械/植入醫療器械的零配件,末道清潔處理應當在相應級別的潔凈室(區)內進行,末道清潔處理介質應當滿足產品質量的要求。與人體組織、骨腔或自然腔體接觸的無菌醫療器械,末道清洗用水應使用符合《中華人民共和國藥典》要求的純化水。
對于植入性醫療器械和直接或間接接觸心血管系統、淋巴系統或腦脊髓液或藥液的無菌醫療器械,若水是最終產品的組成成分時,應使用符合《中華人民共和國藥典》要求的注射用水。若用于末道清洗,應使用符合《中華人民共和國藥典》要求的注射用水或用超濾等其他方法產生的同等要求的注射用水。
以非無菌狀態提供的植入性醫療器械,應當在確認過的清潔條件或凈化條件下進行末道清洗和包裝,清洗水質至少為純化水。
用何種工藝用水清洗潔凈服和工位器具,總的原則是要與物品所處的潔凈區(室)的潔凈級別相匹配,分別清洗,不對所接觸零配件造成污染。潔凈工作服的末道清洗至少用純化水。工位器具的清洗用水要視潔凈級別和要接觸部件的用途而定,設備、工裝上與產品直接接觸的部位及工作臺面、工位器具應定期清洗、消毒、保持清潔。潔凈區(室)內的工位器具應在潔凈區(室)內用純化水進行清洗、消毒。
(二)工藝用水制備方法及系統
1.工藝用水系統處理的對象
水是一種良好的溶劑,能溶解各種固態、液態和氣態的物質,天然水中還存在大量的非溶解物質,另外還包括由于排放造成的廢水、溶解在水中的廢氣和廢渣等有害的物質。天然水中含有各種顆粒物質、電解質、有機物、微生物、溶解氣體等各類物質,不同的水源中雜質的成分、種類和含量也不同,它們就是工藝用水系統處理的對象。
天然水中的顆粒物質包括泥沙、塵埃、有機物、微生物及膠化顆粒等,可用顆粒計數器來反映這類雜質在水中的含量。
電解質是指水中以離子狀態存在的物質,包括可溶性無機物、有機物及帶電的膠體離子等狀態存在于水中,可通過測量水的電導率反映這類電解質在水中的含量。
水中所含有機物主要指天然或人工合成的有機物質,如有機酸、有機金屬化合物等。這類物質體積龐大,常以陰性或中性狀態存在。通常用總有機碳(TOC)測定儀或化學耗氧量法分析此類物質在水中的含量。
水中的微生物包括細菌、浮游生物、藻類及線蟲類,具有個體非常微小、種類繁雜、分布廣、繁殖快、容易發生變異等特點。可用培養法或膜過濾法測定其中含量。
水中溶解氣體,包括CO2、CO、H2S、Cl2、O2、CH4、N2 等,可用氣相色譜、液相色譜和化學測定其含量。
2.純化水制備方法及系統
純化水系統的設計及建造必須考慮到原水的水質、原水中常見污染物的特點及對生產的影響。對某一獨特的水源,應根據其水質特性及供水對象來設計凈化系統。應當根據工藝用水種類和用量確定適宜的制水系統,確保制水系統的功能及配備的設施與工藝用水的制備相適應。
純化水的制備是以原水(一般為飲用水)為原料,經逐級提純水質,使之符合要求的過程。純化水系統通常由預處理系統、制備系統(脫鹽)、后處理系統、分配系統、控制系統組成。
2.1 預處理是通過物理方法、化學方法、電化學方法去除原水中的懸浮物、膠體、微生物等并消除原水中過高的濁度和硬度。其中物理方法有如澄清、砂濾、脫氣、膜過濾、活性碳吸附等。化學方法有混凝、加藥殺菌、消毒、離子交換、氧化-還原等。電化學方法有電凝聚等。
應根據原水特點配備相應的預處理設備,預處理部分包括多介質過濾器、活性碳過濾器、樹脂軟化器(或加藥設備)、精密過濾器(5μm)等。
原水中懸浮物含量較高的需設置過濾裝置(多介質過濾器);原水中硬度較高時,需設置軟化裝置(樹脂軟化器或加藥阻垢設備);原水中有機物或氯氣含量較高,需增加凝聚、活性炭吸附(活性炭過濾器,要設有巴氏消毒裝置);原水中氯離子較高的,為防止對后工序如離子交換、反滲透的影響,需加脫氯裝置(NaHSO3 加藥裝置);細菌多,需采用加氯或臭氧,或紫外線滅菌;用反滲透法制備純化水的,防止大顆粒固體物劃傷反滲透膜應設置5µm 精密過濾器。
2.2 制備過程是對預處理后的水進行脫鹽、純化,除去
水中的絕大多數的離子、細微雜質、有機物、重金屬、細菌、病毒、熱原及其它有害物質。脫鹽過程典型的處理方法為陰陽離子交換、蒸餾冷凝法、電滲析、反滲透、EDI 等,其中,最常見的為反滲透和EDI。
反滲透法(RO):利用反滲透膜,并借助于外界施加的壓力(如水泵壓力)為動力,強制原水中的水分子透過有選擇性透過膜達到除鹽、除雜質的目的,使水得到純化。這種方法操作方便,出水量大,無污染,近年來已被廣泛地使用。制備過程:反滲透(RO )是壓力驅動工藝,利用反滲透
膜去除水中溶解鹽類,同時去除一些有機大分子、前階段沒有去除的小顆粒等。RO 反滲透膜孔徑小至納米級(1 納米=10-9 米),在一定的壓力下,H2O 分子可以通過RO 膜,而原水中的無機鹽、重金屬離子、有機物、膠體、細菌、病毒等雜質無法通過RO 膜,從而使可以透過的純水和無法透過的濃縮水嚴格區分開來。
預處理系統的產水進入反滲透膜組,在壓力作用下,大部分水分子和微量其他離子透過反滲透膜,經收集后成為產品水,通過產水管道進入后序設備;水中的大部分鹽分、膠體和有機物等不能透過反滲透膜,殘留在少量濃水中,由濃水管道排出。
典型的反滲透系統包括反滲透給水泵、阻垢劑加藥裝置、還原劑加藥裝置、5 微米精密過濾器、一級高壓泵、一級反滲透裝置、二級高壓泵、二級反滲透裝置以及反滲透清洗裝置等。
電去離子(Electrodeionization,簡稱EDI)法:是一種將離子交換技術,離子交換膜技術和離子電遷移技術相結合的純水制造技術。具有產水水質高而穩定;連續不間斷制水,不因再生而停機;無需化學藥劑再生;設想周到的堆疊式設計,占地面積小;操作簡單、安全;運行費用及維修成本低;無酸堿儲備及運輸費用;全自動運行,無需專人看護等優點。
制備過程:它將電滲析和離子交換技術相結合,利用兩端電極高壓使水中帶電離子移動,并配合離子交換樹脂及選擇性樹脂膜以加速離子移動去除,從而達到水純化的目的。
EDI 除鹽過程中,離子在電場作用下通過離子交換膜被清除,同時,水分子在電場作用下產生氫離子和氫氧根離子,這些離子對離子交換樹脂進行連續再生,以使離子交換樹脂保持最佳狀態。
EDI 系統中設備主要包括反滲透產水箱、EDI 給水泵、EDI 裝置及相關的閥門、鏈接管道、儀表及控制系統等。EDI單元不能去除水中所有的污染物,它主要是去除離子的或可離子化的物質,但對微生物沒有去除功能。當選用一級 RO+EDI 時,其中間水箱應具備消毒裝置。
2.3 后處理是脫鹽以后水質處理的統稱。一般包括用終端離子交換去除離子痕跡、超過濾、臭氧殺菌等。
2.4 分配系統
按一定溫度、流速輸送至使用點;維持水質,防止退化。包括工藝用水儲罐、純水增壓泵、換熱裝置和輸送管道。應當確定工藝用水的傳輸形式,用量較大時應當通過管道輸送至潔凈室(區)的用水點。通過管道輸送時,應當對工藝用水種類、流向進行標識。
2.5 控制系統
常用形式:PLC、PC+PLC。通常具有自動控制、手動控制功能,自動控制系統用于日常運行控制,手動控制用于緊急情況的控制。
預處理部分控制系統常見功能:原水系統高低液位自動控制補水和原水泵的運行;計量泵自動在線加入絮凝劑,與原水泵同步;介質濾器、活性炭濾器手動、自動沖洗、反沖洗;軟水器手動、自動運行、再生,自動切換。
純化水制備部分控制系統常見功能:RO 自動、手動運行、沖洗;不合格水自動回流;運行參數自動監測。EDI 自動運行,不合格水回流,運行參數自動監測。
注射用水制備部分控制系統常見功能:電導率:進水電導率(不合格自動停機、報警)、產水電導率(不合格自動排放);出水溫度、加熱蒸汽壓力、冷卻水壓力、壓縮空氣壓力不合格自動停機、報警;液位異常檢測、末效濃水自動排放;水機與儲罐液位連鎖控制。
分配系統常見控制功能:儲罐高低液位自動控制;循環泵變頻器根據回水流量檢測信號與設定值比較,對循環泵進行連續PID 控制;送水的溫度、電導率、壓力自動檢測、報警;回水的流速、溫度、電導率自動檢測、報警,不合格自動排放;熱交換器:主回路熱交換器進出口溫度檢測;分配系統的溫度和消毒模式控制。
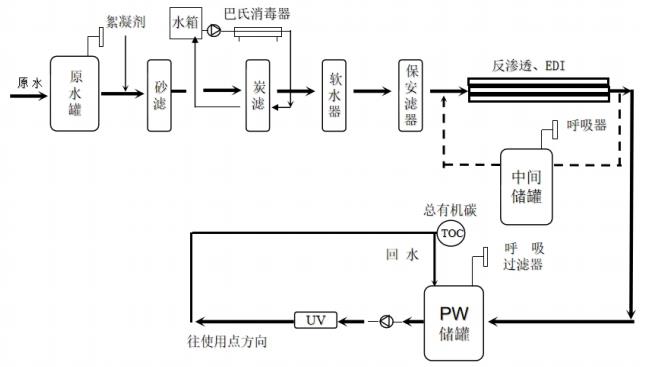
圖1 典型純化水系統綜合配置圖
3.注射用水制備方法及系統
注射用水一般由純化水通過蒸餾等方法制得。注射用水制水裝置除具備純化水工藝用水系統還包括蒸餾器,分配系統還包括注射用水儲罐。
3.1 蒸餾法
蒸餾法是分離、純化液態混合物的一種常用的方法,將液體沸騰產生的蒸氣導入冷凝管,使之冷卻凝結成液體的過程。蒸餾是分離混合物的一種重要的操作技術,尤其是對于液體混合物的分離有重要的實用意義。
制備過程:將純化水經蒸餾水器或蒸餾塔,經過多效蒸餾,制得注射用水。
常用的制備設備為多效蒸餾水機。包括多效蒸發器、冷凝器、熱交換器等。多效蒸餾水機應具備以下功能:
(1)可以實現產水溫度、電導率自動檢測,不合格水自動排放。(2)在設備開機使用前,進行不合格水排放;可以將不合格排放閥組安裝到儲罐頂部,對水機與儲罐之間的管路進行沖洗或滅菌。(3)運行參數可設定、顯示,并有超限報警。

圖2 典型注射用水系統綜合配置圖
3.2 超濾法
超濾是一種加壓膜分離技術,是通過膜表面的微孔結構對物質進行選擇性分離。即在一定的壓力下,使小分子溶質和溶劑穿過一定孔徑的特制的薄膜,而使大分子溶質不能透過,留在膜的一邊,從而得到純化。能除去水中細菌、鐵銹、膠體、大分子有機物、熱原等。此種方法在國內較少見,多見于國外。
制備過程:利用一種壓力活性膜(或中空纖維超濾器),在外界推動力(壓力)作用下截留水中膠體、顆粒和分子量相對較高的物質,而水和小的溶質顆粒透過膜的分離過程。(三)工藝用水系統的確認
應當對制水系統的安裝、運行和性能等進行驗證和確認,確保制水系統持續、穩定生產出符合標準、適合產品生產要求的工藝用水,并保存制水系統驗證計劃、方案、報告以及再確認等相關技術資料。
1.安裝確認(IQ)
純化水系統的安裝確認主要是根據生產要求,檢查水處理設備和管道系統的安裝是否合格,檢查儀表的校準以及操作、維修規程的編寫。
1.1 純化水制備裝置的安裝確認
純化水制備裝置的安裝確認是指機器設備安裝后,對照設計圖紙及供應商提供的技術資料,檢查安裝是否符合設計及規范。
純化水系統安裝確認所需文件主要有:①由質量、技術或相關部門認可的流程圖、系統描述及設計參數; ②水處理設備及管路安裝調試記錄; ③儀器儀表的檢定記錄; ④設備操作手冊及標準操作、維修規程SOP。
純化水處理裝置主要有機械過濾器、活性炭過濾器、軟化器、精密過濾器、脫鹽裝置、水泵、蒸餾水機等,檢查的項目有電氣、連接管道、蒸汽、壓縮空氣、儀表、供水、過濾器等的安裝、連接情況。
1.2 分配系統的安裝確認
應當確保與工藝用水直接接觸的儲罐、輸送管道的材質不對工藝用水造成污染和影響,設計安裝方式應避免死角盲端,以防止微生物的滋生。
(1)管道及閥門的材料
管道選用不銹鋼(304、316L 等型號)。不銹鋼材料的特點是:①鈍化后呈化學惰性; ②易于消毒;③工作溫度范圍廣。
因隔膜閥便于去除閥體內的溶解雜質,微生物不易繁殖,應采用隔膜閥。
(2)管道安裝要求
與工藝用水接觸的表面應拋光,表面粗糙度0.25μ m-0.65μm 為宜,表面的光潔度較低時,細菌容易附著于系
統內壁,利于生物膜的生成。輸送管道的焊接要求焊縫光滑平整,無焊接缺陷。
管道安裝須保持坡度,一般規定為管長的1% ,保證所有管內的水都能排凈避免盲管、死水段,不可避免時符合3D 規則。管內如有積水,必須設置排水點或閥門,注意排水點數量應盡量做到最少。
(3)管道試壓
為了防止系統存在泄漏風險,管道安裝后通常需要對機械強度和連接嚴密性進行水壓試驗,管道機械強度試驗壓力管道無異常現象,壓力不下降即為合格。嚴密性試驗焊縫無泄漏,壓力不下降或下降不超過規定壓力即為合格。
(4)管道的清洗、鈍化、消毒
不銹鋼管道的處理(清洗、鈍化、消毒)可大致分為純化水循環預沖洗→堿液循環清洗→純化水沖洗→鈍化→純化水再次沖洗→排放→純蒸汽消毒等幾個步驟。上述清洗、鈍化、消毒過程及其參數應加以記錄。
1.3 儀器儀表的校準
工藝用水處理裝置上所有的儀器儀表必須定期校準或檢定,使誤差控制在允許的范圍內。純水處理常用的儀表有:電阻(導)儀、時間控制器、流量計、溫度控制儀/記錄儀、壓力表以及分析水質用的各種儀器。需要強調的是紫外燈(UV)等應引起格外的重視,紫外燈校準的參數是:波長、光
強度以及顯示使用時間的時鐘。
1.4 操作手冊和SOP
列出純化水系統所有設備操作手冊和日常操作、維修、監測的SOP 清單。
2.運行確認(OQ)
水系統的運行確認是為確定工藝用水系統能夠按照設定的參數運行,并產生符合標準要求的工藝用水而進行的實際運行試驗。主要通過工藝用水系統試運行,確定預處理系統、脫鹽裝置、后處理裝置、貯存裝置、控制系統和儀器儀表能夠按照預定的設計參數及上下極限參數正常運行,并能生產出符合標準要求的工藝用水。主要內容包括在所有的水處理設備均開動的情況下,檢測系統操作參數和預先測試純化水水質。
2.1 系統操作參數的檢測
①檢查純化水處理各個設備的運行情況。逐個檢查所有的設備,如機械過濾器、活性炭過濾器、軟水器、混合床、蒸餾水機運行是否正常,檢查電壓電流、壓縮空氣、工業蒸汽、供水壓力。
②測定設備的參數。制水設備的各組成部分有不同的功能,通過化驗分析每個設備進、出口處的水質來確定該設備的去除率、效率、產量,看是否達到設計要求。水質分析的指標應根據該設備的性質和用途來定,可對照操作手冊上的參數來進行。
③檢查管路情況,堵漏、更換有缺陷的閥門和密封圈。
④檢查水泵,保證水泵按規定方向運轉。
⑤檢查閥門和控制裝置工作是否正常。
⑥檢查貯水罐的加熱保溫情況,純化水可在(60~70)℃左右貯藏。純化水也可采用常溫循環儲存等措施。
2.2 純化水水質的預先測試分析
在正式開始純化水監測(驗證)之前,先對純化水水質進行測試,以便發現問題及時解決。測試項目主要是化學指標及微生物指標,測點可選擇在脫鹽裝置(如反滲透裝置、蒸餾水機) 出口處。
3.性能確認(PQ)
性能確認旨在通過客觀證據,證明在規定的條件下,能持續的生產出符合要求合格的工藝用水。系統按照設計要求正常運行后,記錄日常操作參數,然后取樣測試。
3.1 本部分驗證是為了保障工藝用水系統的穩定性和可靠性,一般分為三個階段。
第一階段是用2-4 周的時間對工藝用水系統進行全面的監測,在這一段時間內,工藝用水系統應能連續運行,無故障和性能的波動。該階段主要確定合適的操作范圍;制定和最后確定操作、清潔和維修步驟;論證生產和輸送水符合質量;確定工藝用水系統的相關管理和操作規程及工藝用水系統相關記錄表單。該階段生產的工藝用水不可用于實際生產。
第二階段是在第一階段完成后,在制定所有改進后的制度、操作規程的同時進行2-4 周的全面的監測。旨在確認系統能夠在確定的范圍內運行,持續證明生產和輸送水符合質量要求。
第三階段是在第二階段完成后,進行持續一年的連續監測,以證明工藝用水系統能夠長時間的穩定運行,確認季節變化和原水質量的波動對系統穩定性的影響。
第一階段和第二階段應匯總各個取水點的監測數據,進行統計分析,確定水質監測的警戒線和行動限。
3.2 應當制定詳細的取樣計劃,確定工藝用水取樣點,制定取樣點分布圖,取樣點至少應當包括總送水口、總回水口及管路最遠端,在取樣計劃中給出取樣點選擇的依據并規定各個取樣點的取樣頻率,確保取樣點設置合理。
第一階段:一般應每天針對每個取樣點進行全項目檢測。第二階段:一般應每周針對每個取樣點至少進行一次全
項目檢測,但應每天至少針對一個取樣點做一次全項目檢測。
第三階段:取樣點、取樣頻率和檢測項目可基于前兩個階段的情況制定,可逐步簡化到正常的監測模式,但一般應每周至少針對每個取樣點做一次全項目檢測。
對于注射用水,應每天至少針對一個取樣點進行全項目檢測,并且保證每周針對每個取樣點至少進行一次全項目檢測。
3.3 應制定取樣程序,參照實際用水的方法來規定用水點如何取樣。例如,用水點連有軟管的話,取樣應該在軟管的末端;如果操作規程規定在使用前應先沖洗管道,那在這個用水點取樣的時候,也要在沖洗后取樣。
4.再確認
再確認是指一項生產過程、一個系統(設備)或者一種原材料經過驗證并在使用一個階段以后,為證實其驗證狀態沒有發生漂移而進行的確認。一般針對以下情況應重新確認:
(1)生產一定周期后應對工藝用水系統進行再確認,或可采取對歷史數據的回顧和總結的方式對水系統進行再確認。
(2)工藝用水系統搬遷的應進行再確認。
(3)工藝用水系統的維護、部件更換后,生產企業對變化情況進行記錄。同時,還應根據變更部分對整體系統運行質量和穩定性的影響進行評價,必要時應進一步開展檢測和再確認工作。
注射用水正常運行后一般循環水泵不得停止工作,若停用,在正式生產3 個星期前開啟水處理系統并做3 個周期的監控。
(四)質量控制
1.質量控制要求
應當制定工藝用水檢驗規程,確定工藝用水的檢驗項目、方法和檢驗周期,按照法規及相關標準要求對工藝用水指標進行定期檢驗,并保存工藝用水檢驗記錄。對于法規及標準尚未明確規定的,企業應當對水質檢驗的項目、檢驗周期進行驗證和確認。工藝用水檢驗依據以及結果應符合《中華人民共和國藥典》等相關規定。
表1 中國藥典2020年版純化水和注射用水檢驗項目
| 檢驗項目 | 純化水 | 注射用水 |
| 性狀 | 符合規定 | 符合規定 |
| 酸堿度 | 符合規定 | - |
| pH | - | 5.0~7.0 |
| 硝酸鹽 | <0.000006% | 同純化水 |
| 亞硝酸鹽 | <0.000002% | 同純化水 |
| 氨 | <0.00003% | <0.00002% |
| 電導率 | 符合規定(不同溫度有不同規定值) | 符合規定(不同溫度有不同規定值) |
| 同純化水 | ||
| 總有機碳 | <0.50mg/L | |
| 易氧化物 | 符合規定 | - |
| 不揮發物 | 1mg/100mL | 同純化水 |
| 重金屬 | <0.00001% | 同純化水 |
| 細菌內毒素 | - | <0.25EU/mL |
| 微生物限度 | 100CFU/mL | 10CFU/100mL |
注:純化水總有機碳和易氧化物兩項可選做一項。
一般而言,工藝用水的檢驗分為日常檢驗和周期檢驗。日常檢驗項目為每次制水時的檢驗項目,包括pH 值、電導率和氯化物、氨。周期檢驗為全項目檢驗。
2.工藝用水檢驗所需條件
(1)檢驗設備、器具:試管、恒溫水浴鍋、納氏管、滴定管、移液管、具塞量筒、蒸發皿、分析天平、電導率儀、微生物限度檢查用培養基、培養箱、薄膜過濾儀、壓力蒸汽滅菌器、超凈工作臺等。其中周期檢驗一般使用pH 計、電導率儀。微生物限度檢測涉及薄膜過濾儀或微生物限度檢驗儀、培養箱、超凈工作臺;細菌內毒素檢測涉及恒溫水浴鍋。
(2)檢驗試劑:甲基紅、溴麝香草酚藍(檢酸堿度);硝酸、硝酸銀、氯化鋇、草酸銨(檢氯化物、硫酸鹽與鈣鹽);氯化鉀、二苯胺硫酸、標準硝酸鹽溶液(檢硝酸鹽);對氨基苯磺酰胺的稀鹽酸溶液、鹽酸萘乙二胺溶液、標準亞硝酸鹽溶液(檢亞硝酸鹽);堿性碘化汞鉀試液、氯化銨溶液(檢氨)、氫氧化鈣試液(檢二氧化碳);稀硫酸、高錳酸鉀滴定液(檢易氧化物);醋酸鹽緩沖液、硫代乙酰胺試液、標準鉛溶液(檢重金屬);鱟試劑、細菌內毒素工作標準品、細菌內毒素檢查用水(檢細菌內毒素)。其中周期檢驗需要甲基紅、溴麝香草酚藍(檢酸堿度);硝酸、硝酸銀(檢氯化物);堿性碘化汞鉀試液、氯化銨溶液(檢氨)。鱟試劑、細菌內毒素工作標準品、細菌內毒素檢查用水(檢細菌內毒素)。
(3)進行微生物限度、細菌內毒素項目的檢查時,需要在相適應的受控環境下進行,微生物限度項目需具備超凈工作臺。
(五) 運行維護
系統的風險貫穿于其生命周期,初始的驗證可以表明系統是穩定并符合預期,但是在此后的運行過程中應進行日常運行管理與維護保養、持續監控和再驗證,以此來維持系統的驗證狀態。
1.工藝用水系統的日常維護保養
基于部件關鍵性評估的結果,重點對關鍵部件進行日常管理和維護保養,如:紫外燈強度、管道和閥門是否存在泄漏、呼吸器完整性檢測、系統消毒等;多介質、活性炭過濾器日常定期反洗、消毒,必要時重新更換填料;軟水器定時再生,必要時重新更換填料;RO 系統定期清洗,達不到產生質量時更換膜元件;儀表、傳感器的校準等。
維護保養的頻次規定以部件生產廠商的規定為依據,企業可依據制水系統的使用頻次和制水量的大小等因素進行維護保養頻次的規定,必要時形成驗證文件。
2.工藝用水系統的清洗、消毒或滅菌
微生物的控制是通過對水處理設備和分配系統管道的消毒滅菌來達到的,目的是將出水中的微生物數量控制在標準之內。應當確定對制水系統適宜的消毒方法和頻次,并予以驗證。清洗消毒方法不得污染水質,不得對儲罐、輸送管道等造成影響,并保存儲罐、輸送管道清洗消毒、驗證等記錄。
通常純化水的設備和管道消毒方法有巴氏消毒、臭氧消毒、蒸汽消毒、紫外線消毒等,注射用水的分配系統主要是純蒸汽消毒。
(1)化學消毒:常用的有甲醛(35%~40%的甲醛水溶液)、雙氧水、次氯酸鈉等,其中雙氧水使用較多,濃度3%,消毒時間0.5 小時以上。
(2)臭氧消毒:目前在純化水系統中能連續去除細菌和病毒的最好方法,但需在使用點前安裝紫外線燈,保證水中無臭氧殘留。
(3)巴氏消毒:純化水系統采用,較少見。通常使用熱交換器,以蒸汽或電加熱作為熱源,消毒的介質則是系統中的純化水本身;也可以直接將貯罐中的純化水加熱(通過夾套)作為消毒器。水溫應控制在80℃以上,開啟水泵循環沖刷水處理設備和管道(30~60)分鐘。適用于活性炭過濾器、軟化器和儲存循環管路。
(4)蒸汽消毒:多見于制備注射用水。注射用水管系統要能用純蒸汽(如121℃,0.2 MPa)滅菌。貯罐/管道須有滅菌、消毒接口,若采用蒸汽滅菌,應設置足夠的疏水器。適用于耐壓容器和管道。
(5)紫外線消毒:可與熱消毒法或化學消毒法配合使用,有利于過氧化氫和臭氧的降解。波長200nm~300nm 的紫外線有較強的殺菌能力,在253.7nm 的光線效果最好,安裝位置離使用點越近越好。紫外燈滅菌的光強隨時間衰減,應有光強度檢測或時間記錄儀,以便定期清洗或更換紫外燈管。
以下檢查要點的表述主要分為現場觀察企業工藝用水系統及制備環境和查閱企業工藝用水有關的管理文件、記錄兩部分,檢查工藝用水的種類、使用環節、制備方法、使用過程、存儲的規定,及工藝用水有關的法規文件、技術標準,應有明確的工藝用水的標準。在實際檢查過程中應特別注意現場查看、詢問、記錄的情況與企業的規定、文件、記錄的符合性。對于現場檢查的情況,檢查人員應進行適當的記錄。(一)現場觀察企業工藝用水系統及制備環境
1.檢查要點
(1)檢查工藝用水的種類,確保根據工藝用水有關的法規文件、技術標準及所生產產品特性使用的工藝用水符合法規及相關標準規定。
(2)檢查制水系統的適宜性,確保制水系統的功能及配備的設施與工藝用水的制備相適應。現場查看工藝用水系統的結構組成,查看工藝用水系統的狀態標識。
(3)檢查工藝用水的傳輸形式,用量較大時應當通過管道輸送至潔凈室(區)的用水點。通過管道輸送時,應當對工藝用水種類、流向進行標識。現場查看管道標識及布局合理性。
(4)現場查看工藝用水的儲罐和輸送管道應當用不銹鋼或其他無毒材料制,確保與工藝用水直接接觸的儲罐、輸送管道的材質不對工藝用水造成污染和影響。設計安裝方式應避免死角盲端,以防止微生物的滋生。
(5)現場查看工藝用水系統設置的制水監測點,在線監測系統是否能夠正常顯示監測數據,各環節監測數據是否符合要求。
(6)檢查工藝用水取樣點,制定取樣點分布圖,至少應當包括總送水口、總回水口及管路最遠端取樣點,并確保取樣點設置合理。詢問取樣方法,取樣頻率。
(7)現場查看工藝用水系統的清洗消毒設施是否符合要求。詢問制水人員工藝用水的使用環節和儲存要求、系統管道的清洗消毒要求(頻次、消毒方法、操作流程)及管道清洗消毒后的檢驗、驗證確認要求。
(8)現場查看檢驗室用于工藝用水檢驗的有關設備、器具、試劑及儲存環境。應當具備理化指標、微生物限度的檢驗能力和條件。現場查看微生物實驗室,應能夠滿足進行微生物限度和細菌內毒素(需要時)檢測的環境要求,并具有相關器具、試劑。
(9)現場查看檢驗所用的試劑,試劑的存放應滿足試劑說明書的要求。所用的檢驗試劑如為自行制備,應具備制備的設備和器具,試劑上應至少標識試劑名稱、制備人、制備日期以及有效期等信息,詢問相關人員工藝用水檢驗所用試劑的制備方法。
(10)詢問制水人員工藝用水的制備方法和流程。詢問檢驗人員工藝用水的監測和檢驗要求。必要時,要求檢驗人員現場操作檢驗流程。崗位人員應當熟悉相關的法規,具備與崗位相適應的專業知識和工作經驗。
2.常見問題
(1)工藝用水系統輸送管路為普通塑料管,不能提供無毒無害證明。
(2)原水罐呼吸器未定期進行檢查,堵塞導致嚴重后果。
(3)沒有根據檢測的余氯值來更換活性炭,導致RO 膜損壞。長時間停機未對RO 膜進行保護,導致RO 膜損壞。
(4)在線監測設備示值超出規定的監測范圍。
(5)輸送管道未標明管道內工藝用水種類以及流向。
(6)取樣點設置不合理,沒有按照《醫療器械工藝用水管理指南》進行設置。無取樣點標識。取樣點的盲管過長,無法實現有效的清洗消毒。
(7)使用點加裝各種分水裝置,但沒有管理措施。
(8)企業宣稱自行制備試劑(如無氨水),但不具備制備的設備。
(9)制水系統設備操作人員對工作內容不熟悉。
(10)讓檢驗人員現場操作,發現其不能獨立完成相關項目的檢驗工作。
(二)查閱企業工藝用水有關的管理文件、記錄
1.檢查要點
(1)應當保存制水系統的設計圖紙、使用說明書、工藝用水制備流程圖、輸送管道的設計圖紙、技術文件等檔案資料。
(2)應當對制水系統的安裝、運行和性能等進行驗證和確認,確保制水系統持續、穩定生產出符合標準、適合產品生產要求的工藝用水。查閱制水系統驗證計劃、方案、報告以及再確認等相關技術資料。
(3)應當制定工藝用水管理規定,對工藝用水的制備方法、檢驗、使用期限以及儲存要求等內容進行規定,對制水系統操作規程、儲罐和輸送管道清洗消毒方法以及制水系統日常維護、驗證確認等內容進行規定,并保存相關活動記錄。
(4)應當確定對制水系統適宜的消毒方法和頻次,并予以驗證。清洗消毒方法不得污染水質,不得對儲罐、輸送管道等造成影響。查閱儲罐、輸送管道清洗消毒、驗證等記錄。
(5)應當對制水系統進行定期維護。涉及需計量、校驗的儀表、器具應當定期計量、校驗,標識明顯,查閱需計量、校驗的儀表、器具的計量、校驗證書。
委托制水系統廠家進行維護、清洗消毒的,應當與委托制水系統廠家簽訂協議,規定技術要求、質量要求等內容,明確雙方所承擔的質量責任。查閱相關協議和記錄。
(6)應當制定工藝用水檢驗規程,確定工藝用水的檢驗項目、方法和檢驗周期,按照法規及相關標準要求對工藝用水指標進行定期檢驗,并保存工藝用水檢驗記錄。對于法規及標準尚未明確規定的,企業應當對水質檢驗的項目、檢驗周期進行驗證和確認。抽查工藝用水的日常監測記錄、檢驗記錄及報告。
(7)查閱制備工藝用水檢驗試劑配制規定、記錄及試劑配制所需工藝用水使用記錄。
(8)應當對工藝用水系統的產水質量和產水數量進行驗證確認,以證明能夠滿足產品和產量的需要,并保存相關驗證確認記錄。應當結合實際生產需要對工藝用水質量進行定期分析,編寫分析報告,并保存相關記錄。
(9)查閱制水人員、檢驗人員的任命書或上崗證及相關的培訓記錄。
2.常見問題
(1)工藝用水微生物數量指標檢驗規程缺少對取樣后檢驗時效的規定。
(2)工藝用水系統設備發生搬遷,沒有按照工藝用水系統的管理規定進行再確認。
(3)未按照確認的方法對管道進行清洗消毒并保留相關記錄。
(4)工藝用水系統所用的儀器、儀表、檢驗所用設備無校準標識、未經過校準或已過校準有效期。
(5)未保留工藝用水檢驗的原始記錄;檢驗報告中的項目與檢驗規程中規定的項目不一致。
(6)未保留自制備試劑的配置記錄;配置記錄不全,未包括試劑配置所需工藝用水的使用記錄。
(三)其它
1.對于采購工藝用水的情況(即企業無工藝用水系統而通過采購的方式獲得),對供方管理可參照《醫療器械生產企業供應商審核指南》(國家食品藥品監督管理總局2015 年第1 號通告)有關要求,應重點檢查供方的資質、工藝用水檢驗報告和(或)驗證報告,明確運送載體材質、工藝用水的儲存條件、儲存時間等要求,并保存相關記錄。生產企業應對采購用水是否能夠滿足產品本身、生產模式和生產規模的要求進行評價,確保采購的工藝用水滿足產品生產和使用要求。
2.生產企業工藝用水用量較大時應通過管道輸送至潔凈區(室),用量不大時,企業通過載體傳遞工藝用水,應關注工藝用水傳遞的過程是否能夠有效保證工藝用水的質量,工藝用水的輸送或傳遞是否能防止污染。
(一)工藝用水的檢驗要求及檢驗方法
工藝用水的檢驗是保證工藝用水質量的重要保障。為方便使用,依據《中華人民共和國藥典》(2020 年版),給出了純化水和注射用水的檢驗要求和檢驗方法。如《中華人民共和國藥典》相應內容發生變化,應當以最新要求為準。
1.純化水
1.1 檢驗要求
(1)性狀:本品應為無色的澄清液體;無臭。
(2)酸堿度:取本品10mL,加甲基紅指示液2 滴,不得顯紅色;另取本品10mL,加溴麝香草酚藍指示液5 滴,不得顯藍色。
(3)硝酸鹽:不超過0.000006%。
(4)亞硝酸鹽:不超過0.000002%。
(5)氨:不超過0.00003%。
(6)電導率:應符合《中華人民共和國藥典》中“制藥用水電導率測定法”中的規定。
(7)總有機碳:不得過0.50mg/L。
(8)易氧化物 取本品100mL,加稀硫酸10mL,煮沸后,加高錳酸鉀滴定液(0.02mol/L)0.10mL,再煮沸10 分鐘,粉紅色不得完全消失。
以上總有機碳和易氧化物兩項可選做一項。
(9)不揮發物:每100mL樣品中不得過1mg。
(10)重金屬:不得超過0.00001%。
(11)微生物限度:需氧菌總數不得過100cfu/mL。
1.2 檢驗方法
(1)性狀:取本品,在自然光線明亮處,正視目測,并嗅其氣味。
(2)酸堿度
a.儀器及器具:試管。
b.檢驗方法:取2 支試管,每管各加入本品10mL。第一管中加甲基紅指示液2 滴,觀察樣品顏色變化;第二管中加溴麝香草酚藍指示液5 滴,觀察樣品顏色變化。
c.結果判定:加甲基紅指示液2 滴,不得顯紅色;加溴麝香草酚藍指示液5 滴,不得顯藍色。
(3)硝酸鹽
a.儀器及器具:水浴鍋、移液管、納氏比色管。
b.檢驗方法:取適量冰放入盛水的燒杯中,取兩支25mL納氏比色管,分別記號為甲管、乙管。量取本品5mL加入到甲管中,移取標準硝酸鹽溶液(每1mL相當于1μg NO3)0.3mL與無硝酸鹽的水4.7mL至乙管中,兩支試管于冰浴中冷卻,分別加入10%氯化鉀溶液0.4mL和0.1%二苯胺硫酸溶液0.1mL,搖勻,分別移取硫酸5mL,緩緩滴加,搖勻,試管放置于50℃水浴中15 分鐘,比較溶液產生的藍色。
c.結果判定:甲管顏色不得深于乙管顏色。
(4)亞硝酸鹽
a.儀器及器具:移液管、納氏比色管。
b.檢驗方法:取兩支25mL納氏比色管,分別記號為甲管、乙管。量取本品10mL加入到甲管中,移取標準亞硝酸鹽溶液(每1mL相當于1μg NO2) 0.2mL和無亞硝酸鹽的9.8mL至乙管中,兩管分別加入對氨基苯磺酰胺的稀鹽酸溶液(1→100)1mL及鹽酸萘乙二胺溶液(0.1→100)1mL,比較溶液產生的粉紅色。
c.結果判定:甲管顏色不得深于乙管顏色。(5)氨a.儀器及器具:量筒、納氏比色管。
b.檢驗方法:取兩支50mL納氏比色管,分別記號為甲管、乙管。取本品50mL至甲管中,另取氯化銨溶液(取氯化銨31.5mg,加無氨水適量使溶解并稀釋成1000mL)1.5mL和無氨水48mL至乙管中,兩管分別加入堿性碘化汞鉀試液2mL,放置15 分鐘;兩管做顏色比較。
c.結果判定:甲管顏色不得深于乙管顏色。
(6)電導率
a.儀器及器具:溫度計、電導率儀。
b.檢驗方法:取本品約50mL,測定其溫度,用校好的電導率儀測定該溫度下的電導率。
c.結果判定:
測得樣品的電導率值不得大于相同溫度下的限度值。
(7)總有機碳
a.儀器及器具:總有機碳檢測儀。
b.檢驗方法:取本品約50mL,用經校正的總有機碳檢測儀測定其總有機碳。
c.結果判定:總有機碳不得過0.50mg/L。
(8)易氧化物
a.儀器及器具:量筒、刻度吸管。
b.檢驗方法:取本品100mL,加稀硫酸10mL,煮沸后,加高錳酸鉀滴定液(0.02mol/L)0.10mL,再煮沸10 分鐘。
c.結果判定:粉紅色不得完全消失。
(9)不揮發物
a.儀器及器具:蒸發皿、量筒、數顯鼓風干燥箱、電子天平。
b.檢驗方法:量取本品100mL加入到105℃干燥至恒重的蒸發皿M0 中,在水浴上蒸干,置于105℃的烘箱中干燥至恒重M1,按下式計算:不揮發物m=M1-M0。
c.結果判定:不揮發物不得過1mg。
(10)重金屬
a.儀器及器具:量筒、納氏比色管、水浴鍋。
b.檢驗方法:取25mL納氏比色管兩支,分別記號為甲管、乙管。量取本品100mL,加水19mL,至蒸發皿或燒杯中,蒸發至20 mL,放冷后加入到甲管中,乙管加標準鉛溶液1.0mL和水19mL,兩管中分別加入醋酸鹽緩沖液(pH3.5)2mL后,加水稀釋成25 mL,再在甲乙兩管中分別加硫代乙酰胺試液各2mL,搖勻,放置2 分鐘,同置白紙上,自上向下透視,觀察結果。
c.結果判定:甲管顏色不得深于乙管顏色。
(11)微生物限度
a.儀器及器具:一次性無菌注射器、薄膜過濾器、數顯鼓風干燥箱、電子天平、凈化工作臺、蒸汽滅菌器、生化培養箱。
b.檢驗方法:取本品1mL置于薄膜過濾器上,立即過濾,pH7.0 的無菌氯化鈉-蛋白胨緩沖液100mL沖洗,取出濾膜,菌面朝上貼于R2A 瓊脂培養基上,于30~35℃培養不少于5 天,計數。同時進行陰性對照試驗。
c.結果判定:1mL供試品中需氧菌總數不得過100cfu。
2 注射用水
2.1 檢驗要求
(1)性狀:本品應為無色的澄明液體;無臭。
(2)pH 值:應為5.0-7.0。
(3)硝酸鹽:不超過0.000006%。
(4)亞硝酸鹽:不超過0.000002%。
(5)氨:不超過0.00002%。
(6)電導率:應符合《中華人民共和國藥典》“制藥用水電導率測定法”中的規定。
(7)總有機碳:不得過0.50mg/L。
(8)不揮發物:每100mL樣品中不得過1mg。
(9)重金屬:不得超過0.00001%。
(10)細菌內毒素:應小于0.25EU/mL。
(11)微生物限度:需氧菌總數不得過10cfu/100mL。
2.2 檢驗方法
(1)性狀:取本品,在自然光線明亮處,正視目測,并嗅其氣味。
(2)pH 值
a.儀器及器具:酸度計。
b.檢驗方法:取本品100mL,加飽和氯化鉀溶液0.3mL,用校正過的酸度計測定。
c.結果判定:應為5.0-7.0。
(3)硝酸鹽
a.儀器及器具:水浴鍋、移液管、納氏比色管。
b.檢驗方法:取適量冰放入盛水的燒杯中,取兩支25mL納氏比色管,分別記號為甲管、乙管。量取本品5mL加入到甲管中,移取標準硝酸鹽溶液(每1mL相當于1μg NO3)0.3mL與無硝酸鹽的水4.7mL至乙管中,兩支試管于冰浴中冷卻,分別加入10%氯化鉀溶液0.4mL和0.1%二苯胺硫酸溶液0.1mL,搖勻,分別移取硫酸5mL,緩緩滴加,搖勻,試管放置于50℃水浴中15 分鐘,比較溶液產生的藍色。
c.結果判定:甲管顏色不得深于乙管顏色。
(4)亞硝酸鹽
a.儀器及器具:移液管、納氏比色管。
b.檢驗方法:取兩支25mL納氏比色管,分別記號為甲管、乙管。量取本品10mL加入到甲管中,移取標準亞硝酸鹽溶液(每1mL相當于1μg NO2) 0.2mL和無亞硝酸鹽的9.8mL至乙管中,兩管分別加入對氨基苯磺酰胺的稀鹽酸溶液(1→100)1mL及鹽酸萘乙二胺溶液(0.1→100)1mL,比較溶液產生的粉紅色。
c.結果判定:甲管顏色不得深于乙管顏色。
(5)氨
a.儀器及器具:量筒、納氏比色管。
b.檢驗方法:取兩支50mL納氏比色管,分別記號為甲管、乙管。取本品50mL至甲管中,另取氯化銨溶液(取氯化銨31.5mg,加無氨水適量使溶解并稀釋成1000mL)1.0mL和無氨水49mL至乙管中,兩管分別加入堿性碘化汞鉀試液2mL,放置15 分鐘;兩管做顏色比較。
c.結果判定:甲管顏色不得深于乙管顏色。
(6)電導率
a.儀器及器具:溫度計、電導率儀。
b.檢驗方法:取本品約120mL,測定其溫度,用校好的電導率儀測定該溫度下的電導率。
c.結果判定:應符合《中華人民共和國藥典》“制藥用水電導率測定法”中的規定。
(7)總有機碳
a.儀器及器具:總有機碳檢測儀。
b.檢驗方法:取本品約50mL,用經校正的總有機碳檢測儀測定其總有機碳。
c.結果判定:總有機碳不得過0.50mg/L。
(8)不揮發物
a.儀器及器具:蒸發皿、量筒、數顯鼓風干燥箱、電子天平。
b.檢驗方法:量取本品100mL加入到105℃干燥至恒重的蒸發皿M0 中,在水浴上蒸干,置于105℃的烘箱中干燥至恒重M1,按下式計算:不揮發物m=M1-M0。
c.結果判定:不揮發物不得過1mg。
(9)重金屬
a.儀器及器具:量筒、納氏比色管、水浴鍋。
b.檢驗方法:取25mL納氏比色管兩支,分別記號為甲管、乙管。量取本品100mL,加水19mL,至蒸發皿或燒杯中,蒸發至20 mL,放冷后加入到甲管中,乙管加標準鉛溶液1.0mL和水19mL,兩管中分別加入醋酸鹽緩沖液(pH3.5)2mL后,加水稀釋成25mL,再在甲乙兩管中分別加硫代乙酰胺試液各2mL,搖勻,放置2 分鐘,同置白紙上,自上向下透視,觀察結果。
c.結果判定:甲管顏色不得深于乙管顏色。
(10)細菌內毒素
a.儀器及器具:移液器、電子天平、凈化工作臺、旋渦混合器、水浴鍋、數顯鼓風干燥箱、內毒素檢測儀。
b.檢驗方法
供試品溶液的制備:取樣品0.5mL加細菌內毒素檢查用水0.5mL,混勻后得供試品溶液。
PC/PPC 液的制備:取5EU/mL的工作標準品1 支,加檢查用水1mL,混勻后得5EU/mL的內毒素標準溶液;取5EU/mL的內毒素標準溶液0.1mL和檢查用水0.9mL,混勻后得0.5EU/mL的內毒素標準溶液;取0.5EU/mL的內毒素標準溶液0.3mL和檢查用水0.3mL,混勻后得0.25EU/mL的內毒素標準溶液,即PC 溶液;取0.5EU/mL的內毒素標準溶液0.3mL和樣品0.3mL,混勻后得PPC 溶液。
檢驗步驟:取復溶后的0.125EU/mL0.1mL/支的鱟試8 支,分別加入0.1mL供試品溶液、PPC 溶液、PC 溶液和內毒素檢查用水各兩支,將溶液輕輕混勻后,封閉管口,垂直放入37℃±1℃的恒溫器中,保溫60 分鐘±2 分鐘。
c.結果判定:供試品溶液應顯陰性;PPC、PC 溶液應顯陽性;陰性對照(NC)應顯陰性。
(11)微生物限度
a.儀器及器具:一次性無菌注射器、薄膜過濾器、數顯鼓風干燥箱、電子天平、凈化工作臺、蒸汽滅菌器、生化培養箱。
b.檢驗方法:取本品100mL置于薄膜過濾器上,立即過濾,用pH7.0 的無菌氯化鈉-蛋白胨緩沖液100mL沖洗,取出濾膜,菌面朝上貼于R2A 瓊脂培養基上,于30~35℃培養不少于5 天,計數。同時進行陰性對照試驗。
c.結果判定:100mL供試品中需氧菌總數不得過10cfu。
(二)工藝用水系統組件的作用
附表1 工藝用水系統組件的作用
| 工藝用水系統主要組件 | 作用 | 適用的制備方法 |
| 原水儲罐 | 緩沖市政供水水量波動。 | 通用 |
| 多介質過濾器 | 截留水中細小顆粒雜質下來,降低濁度。 | 通用 |
| 活性炭過濾器 | 吸附水中的有機物和余氯。 | 通用 |
| 樹脂軟化器 | 去除鈣鎂離子,降低水的硬度。 | 通用 |
| 加藥阻垢裝置 | 防止鈣鎂鐵錳等離子在反滲透膜上結垢。 | 反滲透法 |
| 5µm 過濾器 | 保證反滲透膜不被大顆粒的固體物劃傷。 | 反滲透法 |
| 電滲析裝置 | 脫除水中陰、陽離子。 | 離子交換法 |
| 離子交換器 | 脫除水中陰、陽離子。 | 離子交換法 |
| 反滲透裝置 | 脫除水中陰、陽離子。 | 反滲透法 |
| EDI 裝置 | 脫除水中陰、陽離子。 | 反滲透法 |
| 蒸餾水機 | 脫除水中陰、陽離子和細菌內毒素等。 | 離子交換法 |
| 超過濾裝置 | 脫除水細菌、內毒素等。 | 通用 |
| 紫外殺菌器 | 在線殺滅水中微生物。 | 通用 |
| 臭氧發生器 | 定期殺滅供水系統中滋生的微生物。 | 通用 |
| 純蒸汽發生器 | 定期殺滅制備、供水系統中滋生的微生物。 | 通用 |
| CIP 消毒裝置 | 定期殺滅制備、供水系統中滋生的微生物。 | 通用 |
| 工藝用水儲罐 | 緩沖用戶工藝用水水量波動。 | 通用 |
| 純水增壓泵 | 為工藝用水系統提供必要的壓力。 | 通用 |
| 換熱裝置 | 工藝用水的升溫或降溫。 | 通用 |
(三)常見的工藝用水系統的維護保養方法
附表2 和附表3 給出了常見的工藝用水系統的維護保養和二級反滲透膜清洗的方法,供參考。這些具體方法和要求不一定適用于某些工藝用水系統。
附表2 工藝用水系統的維護與保養
| 維護項目 | 維護方法 | 維護頻次 |
|---|---|---|
| 原水箱 | 用飲用水沖洗干凈,清洗后用肉眼不得看到有懸浮物,應澄清、透明、無色無臭。兩個原水泵每月交替使用。 | 每月 |
| 多介質過濾器 | 先進行反沖洗 15 分鐘再正洗 10 分鐘。 | 每 三 天 或 進 出 水 的 壓 差 超 過0.12MPa |
| 精密過濾器 | 更換濾芯 | 每 半 年 或 當 進 出 水 壓 差 達 到0.05MPa。 |
| 精密過濾器 | 用毛刷刷洗過濾器內壁 | 每季度 |
| 活性炭過濾器 | 先進行反沖洗 15 分鐘再正洗 10 分鐘 | 累計 7 天或進出水的壓差超過0.08MPa。 |
| 徹底更換一次活性炭,活性炭規格型號為粒徑 2-4mm 的果殼活性炭,裝載量為 1.2-1.5m 高度或位于視鏡的中間位置。 | ①余氯超標或消毒后細菌總數不能恢復到平均值時;②每三年。 | |
| 反滲透裝置短期停運 | 短期停運期間每天運行 1~2 小時 | 停運 5~30 天 |
| 反滲透裝置長期停運 |
①用鹽酸溶液(pH=4),把反滲透裝置清洗干凈,清洗時間為 40~60 分鐘。 ②酸溶液清洗完畢后,再用純化水把反滲透裝置清洗至出水電導率、酸堿度與原沖洗水電導率、酸堿度一致為止。 ③清洗完畢后,反滲透裝置清洗系統注入 1%NaHSO3進行保護(冬季應使用 1%NaHSO3+20%丙二醇溶液保護,以防凍裂),反滲透裝置注滿保護液后,關閉所有閥門,防止空氣進入反滲透裝置。注:所用 pH 值為 4 的鹽酸溶液,1%NaHSO3和 20%丙二醇溶液保護液,均須用純化水配制,試劑須用分析純。 |
停運 30 天以上 |
| 反滲透膜 | 對反滲透膜進行清洗 |
①產水量降低了(10~15)%或顯然發生結垢及堵塞時;②高壓泵后壓力(膜前壓力)與濃水壓力(膜后壓力)差,即一級膜前壓力與一級膜后壓力差、二級膜前壓力與二級膜后壓力差,大于0.2MPa 時;③在長期停用前。
|
| 多介質過濾器 | 添加石英砂濾料至試鏡 1/2 處。 | 每年 |
附表3 二級反滲透膜的清洗方法
| 維護項目 | 維護方法 |
| 反滲透膜清洗 | ①清洗所用化學試劑都必須是分析純;所有溶液必須用純化水配制;②酸洗液的配置:用2%檸檬酸溶液加0.2%EDTA-2Na,用氨水調節pH 值為4;③堿洗液的配制:用NaOH 加0.2%EDTA-2Na 調節pH 值為10;④一般清洗液的使用量為:8040-1 膜組件配制35.5 升。清洗方法:一般清洗步驟是先用酸性溶液清洗,然后用堿性溶液清洗,最后用反滲透產水或預處理產水沖洗反滲透膜至產水水質及產水量符合生產要求為止。 |
| 清洗準備:①沖洗反滲透組件,排除運行過程中剩余濃水和給水通道中污染物②清理清洗用的水箱、管路、新使用的精密過濾器 ③用塑料軟管連接清洗裝置。 | |
| 清洗:①關閉高壓泵流量調節閥,關閉濃水回流閥,全開濃水調節閥或電磁閥旁通閥,啟動清洗泵,向膜組件中注水,注意壓力不能超過0.4MPa。將膜組件剛開始排出的水放掉。然后將清洗液回流到清洗水箱。②對膜組件清洗液循環40 分鐘。注意,溫度不能超過40度,如果超過則停機降溫;pH 值的變化不能超過0.5 個單位,如果超過則投加清洗試劑。③如污染嚴重,可采用循環40 分鐘,浸泡30 分鐘的方法。④按上述方法進行清洗、浸泡2-3 次。⑤進行低壓沖洗。用反滲透產水或預處理水對膜組件進行沖洗,洗至排水呈中性為止。⑥酸洗后用1%的甲醛進行浸泡消毒20 小時。⑦堿洗:將反滲透裝置中的甲醛溶液排出,換堿洗清洗液進行清洗。向膜組件中注堿洗液,注意壓力不能超過0.4MPa。將膜組件剛開始排出的水放掉。然后將堿洗液回流到清洗水箱。循環40 分鐘。注意:溫度不能超過40℃,如果超過則停機降溫。⑧進行低壓沖洗。用反滲透產水或預處理水對膜組件進行沖洗,洗至排水呈中性為止。⑨清洗裝置及清洗管路清洗到呈中性為止。⑩全部清洗完畢后,拆去清洗裝置,將反滲透主機的各閥門調到正常工作的位置,正常開機,進行沖洗,將產水也排掉,直至產水電導率和產水量符合純化水質量要求。否則繼續進行清洗。 |
(四)參考文獻
1.《醫療器械監督管理條例》(國務院令739號)
2.《關于發布醫療器械生產質量管理規范的公告》(國家食品藥品監督管理總局公告2014年第64號)
3.《關于發布醫療器械生產質量管理規范附錄無菌醫療器械的公告》(國家食品藥品監督管理總局公告2015年第101號)
4.《關于發布醫療器械生產質量管理規范附錄植入性醫療器械的公告》(國家食品藥品監督管理總局公告2015年102號)
5.《關于發布醫療器械生產質量管理規范附錄體外診斷試劑的公告》(國家食品藥品監督管理總局公告2015年第103號)
6.《關于印發醫療器械生產質量管理規范現場檢查指導原則等4 個指導原則的通知》(食藥監械監〔2015〕218 號)
7.《關于發布醫療器械工藝用水質量管理指南的通告》(2016年第14號)
8.《中華人民共和國藥典》2020年版
9.《無菌醫療器具生產管理規范》(YY/T 0033-2000)
10.《生活飲用水衛生標準》(GB 5749-2006)
11.《分析實驗室用水規格和試驗方法》(GB/T 6682-2008)
12.《體外診斷試劑用純化水》(YY/T1244-2014)
13.《高純水系統檢查指南》(FDA)
14.《制藥用水和蒸汽系統試運行和確認》(國際制藥工程協會)

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
《海南博鰲樂城國際醫療旅游先行區臨床急需進口藥品帶離先行區使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行

為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《
《海南博鰲樂城國際醫療旅游先行區醫療機構制劑調劑使用管理暫行辦法》已經3月24日海南博鰲樂城國際醫療旅游先行區領導小組會議審議通過,現印發給你們,請遵照執行。

關于發布醫療器械質量管理體系年度自查報告編寫指南的通告(2022年第13號)發布時間:2022-03-24為加強醫療器械生產監管,保障醫療器械安全有效,根據《醫

國家藥監局關于發布免于進行臨床評價醫療器械目錄的通告(2025年第19號)發布時間:2025-05-13為做好醫療器械注冊管理工作,根據《醫療器械注冊與備案管理

《醫療器械監督管理條例》已經2020年12月21日國務院第119次常務會議修訂通過,現予公布,自2021年6月1日起施行。

附件:醫療器械監督管理條例(2025年修訂版).doc醫療器械監督管理條例(2000年1月4日中華人民共和國國務院令第276號公布 2014年2月12日國務院第

為深化醫療器械審評審批制度改革,加強醫療器械臨床試驗管理,根據《醫療器械監督管理條例》(國務院令第739號)及《醫療器械注冊與備案管理辦法》(市場監管總局令第47號)、《

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
