國(guó)內(nèi)凝血分析流水線產(chǎn)品盤點(diǎn)(沃芬/希森美康/思塔高和艾科達(dá))
隨著國(guó)家醫(yī)療改革的不斷深入,使得綜合性大中型醫(yī)療機(jī)構(gòu)的中心實(shí)驗(yàn)室對(duì)自動(dòng)化系統(tǒng)有了新的要求,為了簡(jiǎn)化檢測(cè)流程,提高檢測(cè)效率,保證數(shù)據(jù)準(zhǔn)確度等,中心實(shí)驗(yàn)室對(duì)集中化診斷


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2022-07-06 閱讀量:次
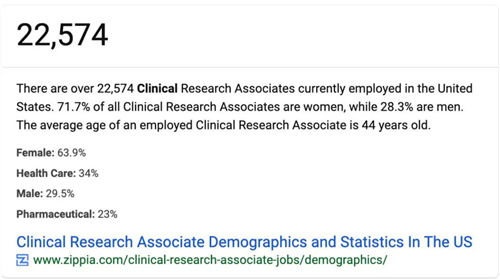
前段時(shí)間一個(gè)朋友發(fā)了一個(gè)截圖給我,說他檢索到美國(guó)有2萬多名CRA,問我:“你們知道的數(shù)據(jù)比較多,國(guó)內(nèi)目前到底有多少CRA啊?”
圖:公開資料顯示美國(guó)有22574名CRA,71.7%為女性,28.%為男性,平均年齡為44歲
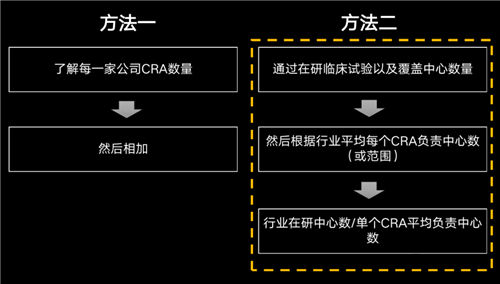
計(jì)算國(guó)內(nèi)CRA數(shù)量的方法可能有很多種,如下兩種個(gè)人覺得還是相對(duì)靠譜的:
方法一:統(tǒng)計(jì)行業(yè)內(nèi)各家CRO、藥企公司內(nèi)CRA數(shù)量,相加即可。
方法二:通過分析在研臨床試驗(yàn)以及覆蓋的中心數(shù)量,然后根據(jù)行業(yè)平均每個(gè)CRA負(fù)責(zé)中心數(shù),最后利用行業(yè)在研中心數(shù)除以單個(gè)CRA平均負(fù)責(zé)中心數(shù),即可得到CRA數(shù)量。
當(dāng)然方法一肯定更加精準(zhǔn),但執(zhí)行起來難度比較大,基于數(shù)據(jù)優(yōu)勢(shì),今天用方法二給大家大致推算國(guó)內(nèi)到底有多少CRA!
利用使用方法二計(jì)算國(guó)內(nèi)CRA數(shù)量,首先要了解國(guó)內(nèi)在研的臨床研究及覆蓋中心情況!
我們對(duì)CDE藥物臨床試驗(yàn)信息登記與公示平臺(tái)的試驗(yàn)做了分析,截至2022年5月28日,在CDE登記公示平臺(tái)上標(biāo)識(shí)為“進(jìn)行中”的項(xiàng)目有7713個(gè),當(dāng)然“進(jìn)行中”也包含3種狀態(tài),分別是“尚未招募”、“招募中”及“招募完成”。
如果已經(jīng)在CDE平臺(tái)登記且狀態(tài)是“進(jìn)行中-尚未招募”大概率項(xiàng)目還在SSU期間,這類項(xiàng)目有2625個(gè);
“進(jìn)行中-招募中”項(xiàng)目有3510個(gè),這類項(xiàng)目大家可以當(dāng)做是在入組期!
“進(jìn)行中-招募完成”項(xiàng)目有1575個(gè),這類項(xiàng)目應(yīng)該在隨訪或關(guān)中心期!

7713個(gè)“在研”項(xiàng)目分布在1520家中心,1520是去重之后的結(jié)果,如果不去重,則有78020個(gè)Site頻次有在研的項(xiàng)目在進(jìn)行!
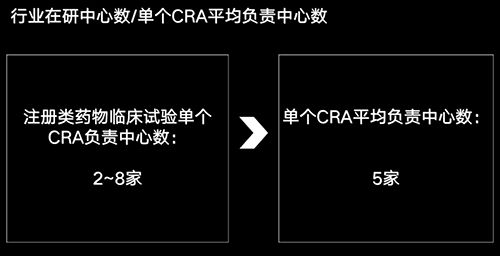
我們知道在CDE登記的都是注冊(cè)類藥物試驗(yàn),針對(duì)注冊(cè)類項(xiàng)目,有過CRA相關(guān)經(jīng)驗(yàn)的都知道,每個(gè)CRA負(fù)責(zé)中心數(shù)一般在2~8家。
當(dāng)然CRA負(fù)責(zé)的中心數(shù)量和CRA經(jīng)驗(yàn)、企業(yè)性質(zhì)(CRO or 藥企)、項(xiàng)目類型、項(xiàng)目階段、入組受試者數(shù)量等很多因素有關(guān)系。
今天我們用平均數(shù)5作為行業(yè)的“單個(gè)CRA平均負(fù)責(zé)中心數(shù)”。大家不用太較真這個(gè)數(shù)字是不是精準(zhǔn),因?yàn)榻裉熘皇墙榻B一種方法,得出一個(gè)相對(duì)靠譜的、可供大家參考的粗略數(shù)字。
這樣國(guó)內(nèi)CRA數(shù)量就呼之欲出了,78020 ? 5= 15604。當(dāng)然這是基于CDE公示的臨床試驗(yàn)數(shù)算出來的,而大家都知道,在CDE登記公示的臨床試驗(yàn)都是注冊(cè)類藥物臨床試驗(yàn),所以可以得出這樣的結(jié)論:國(guó)內(nèi)從事注冊(cè)類藥物臨床試驗(yàn)監(jiān)查的CRA差不多有1.5萬人!
除了注冊(cè)類藥物臨床試驗(yàn),我們知道還有大量的CRA在負(fù)責(zé)上市后的藥物臨床試驗(yàn),另外也有不少器械類的CRA!

當(dāng)然在“中國(guó)臨床試驗(yàn)注冊(cè)中心”上登記了很多非注冊(cè)類藥物及一些器械類試驗(yàn),因?yàn)榻^大部分都是IIT(研究者發(fā)起類)研究,這些項(xiàng)目很多不一定有監(jiān)查,所以不太能作為參考數(shù)據(jù)!
不過個(gè)人經(jīng)驗(yàn),綜合以上3個(gè)部分,國(guó)內(nèi)CRA數(shù)量和美國(guó)應(yīng)該差別不大,往多一點(diǎn)說應(yīng)該在3萬左右!
之前聽行業(yè)內(nèi)有人說5萬、甚至10萬的,肯定是達(dá)不到的!
注:有的朋友可能會(huì)提醒,在CDE登記公示的試驗(yàn)可能不夠精準(zhǔn),確實(shí)有一些企業(yè)會(huì)晚一些更新自己的試驗(yàn)狀態(tài),有可能試驗(yàn)結(jié)束了顯示的還是“進(jìn)行中”,甚至新增或刪除了一些中心也沒有及時(shí)上去更新。這一點(diǎn)大家不用太擔(dān)心,這幾年隨著CDE及藥物臨床試驗(yàn)機(jī)構(gòu)對(duì)這塊試驗(yàn)公開的信息重視,信息登記公示越來越精準(zhǔn),這個(gè)原因造成的誤差沒有這么大!

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

隨著國(guó)家醫(yī)療改革的不斷深入,使得綜合性大中型醫(yī)療機(jī)構(gòu)的中心實(shí)驗(yàn)室對(duì)自動(dòng)化系統(tǒng)有了新的要求,為了簡(jiǎn)化檢測(cè)流程,提高檢測(cè)效率,保證數(shù)據(jù)準(zhǔn)確度等,中心實(shí)驗(yàn)室對(duì)集中化診斷

2020年初,公眾號(hào)臨研人之家聯(lián)合藥研社開展了一項(xiàng)匿名的橫截面在線問卷調(diào)查。調(diào)查對(duì)象是中國(guó)境內(nèi)的在職CRA和CRC(不含項(xiàng)目經(jīng)理、人事主管等其他臨床試驗(yàn)相關(guān)職位)。調(diào)查目的旨在

我之前是一個(gè)做了兩年多的CRC,現(xiàn)在轉(zhuǎn)行做了CRA,在行業(yè)中有很多的CRC做到一定時(shí)間后會(huì)考慮晉升或者轉(zhuǎn)CRA,是一個(gè)普遍的現(xiàn)象。相對(duì)比不同的,無非是有沒有經(jīng)驗(yàn),有的會(huì)聘用無經(jīng)驗(yàn)

盡管處在一個(gè)快速發(fā)展的陽光產(chǎn)業(yè),在機(jī)會(huì)面前中國(guó)CRC也面臨著很多挑戰(zhàn),這些挑戰(zhàn)大致可以包括:工作強(qiáng)度大、任務(wù)重、壓力大;協(xié)調(diào)工作難度大,不可控因素多;工作繁雜,工作交

一個(gè)產(chǎn)品帶有CE 標(biāo)志(標(biāo)記) 也就意味著其制造商宣告:該產(chǎn)品符合歐洲的健康、安全、與環(huán)境保護(hù)之相關(guān)法律中所規(guī)定 的基本要求。因而該產(chǎn)品是對(duì):使用者(譯者注:人)、寵物(

近日美國(guó)食品藥品監(jiān)督管理局(FDA)更新了《醫(yī)療器械提交的反饋申請(qǐng)和會(huì)議申請(qǐng):Q-Submission指導(dǎo)原則》。此文件是對(duì)2019版Q-sub指導(dǎo)原則的更新,更新的主要內(nèi)容如下:1. 增加了STeP醫(yī)療
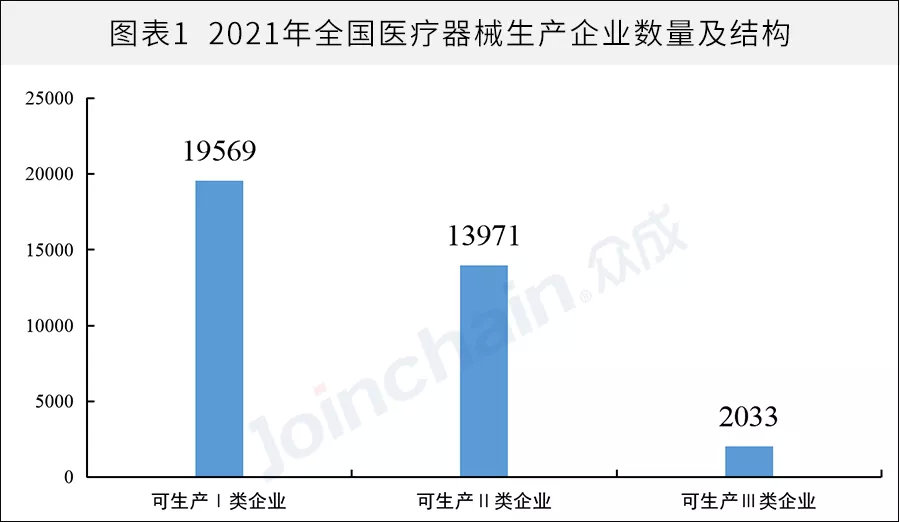
據(jù)眾成數(shù)科統(tǒng)計(jì),截至2021年12月31日,全國(guó)醫(yī)療器械生產(chǎn)企業(yè)數(shù)量達(dá)28954家,較2020年的25440家同比增長(zhǎng)13.8%。其中,可生產(chǎn)Ⅰ類產(chǎn)品企業(yè)19569家,可生產(chǎn)Ⅱ類產(chǎn)品13971家,可生產(chǎn)Ⅲ類產(chǎn)品

體外診斷(In Vitro Diagnosis,下稱IVD),是在人體之外,通過對(duì)人體樣本(血液、體液、組織等)進(jìn)行檢測(cè)而獲取臨床診斷信息,進(jìn)而判斷疾病或機(jī)體功能的產(chǎn)品和服務(wù)。IVD已經(jīng)成為人類

在鶴壁辦理一張醫(yī)療器械經(jīng)營(yíng)許可證要多少錢?只要有人員有場(chǎng)地滿足辦理的要求,就可以自行辦理。自行辦理是免費(fèi)的哦!本文為大家科普一下找代辦機(jī)構(gòu)辦理的情況下,鶴壁醫(yī)療器械經(jīng)營(yíng)許

美國(guó)食品藥品監(jiān)督管理局FDA宣布,其計(jì)劃采用ISO13485標(biāo)準(zhǔn)作為其質(zhì)量體系立法的基礎(chǔ)。FDA如采用ISO13485標(biāo)準(zhǔn)替代其現(xiàn)有的質(zhì)量體系法規(guī),則代表該標(biāo)準(zhǔn)的認(rèn)可度獲得進(jìn)一步的提高,已經(jīng)成
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
