長江三角洲區域醫療器械注冊人制度試點工作實施方案(試行)(滬藥監械管〔2019〕112號)
為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械
來源:醫療器械注冊代辦 發布日期:2024-05-27 閱讀量:次
附件:醫用氣體報警系統注冊審查指導原則(2024年第19號).doc
本指導原則旨在指導注冊申請人對醫用氣體報警系統注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。
本指導原則是對醫用氣體報警系統的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件,但不包括審評審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。如果有能夠滿足相關法規要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下制定,隨著法規和標準的不斷完善,以及科學技術的不斷發展,相關內容也將適時進行調整。
本指導原則適用于醫用氣體報警系統。相關設備,如醫用壓縮氣體供應系統、醫用氣體匯流排及真空供應系統等,包含氣體監測、報警功能的可參照本指導原則執行。
本指導原則不適用于牙科真空系統的報警。
(一)監管信息
1.產品名稱
產品名稱應符合《醫療器械通用名稱命名規則》《呼吸、麻醉和急救器械通用名稱命名指導原則》的要求,建議使用醫療器械分類目錄和國家標準、行業標準上的通用名稱。產品名稱示例:醫用氣體報警器、醫用氣體報警系統。
2.分類編碼
根據《醫療器械分類目錄》,分類編碼為08-07-06,管理類別為Ⅱ類。
3.注冊單元劃分的原則和實例
注冊單元劃分原則上以產品的技術原理、結構及組成、性能指標和適用范圍為依據,并建議結合以下幾方面進行考慮:
3.1結構及組成
技術原理相同,產品主要結構、組成的不同對安全有效性有影響的,原則上應劃分為不同的注冊單元。
如:包含氣體傳感器、顯示面板、控制電路和集中監測與報警管理系統的醫用氣體報警系統與僅包含氣體傳感器、顯示面板和控制電路的醫用氣體報警器應劃分為不同注冊單元。
3.2適用范圍
性能指標差異導致適用范圍不同,原則上應劃分為不同的注冊單元。
如:氣源報警和區域報警應劃分為不同的注冊單元。
3.3適用范圍、產品性能和結構組成基本相同的不同型號醫療器械,原則上劃分為同一注冊單元。
如:僅監測的氣體種類、參數和采集單元不同,可劃分為同一注冊單元。針對相同采集參數,僅傳感器工作原理不同的可劃分為同一注冊單元,但需區分型號規格。
(二)綜述資料
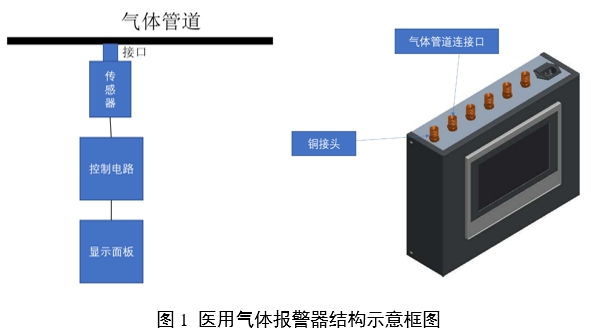
1.產品的結構和組成
注冊申請人應對醫用氣體報警系統總體構造進行詳細描述(建議采用結構示意框圖及文字釋義),包括所有組成部分,給出部件/組件的說明(如圖表、照片或圖紙),明確關鍵部件/組件。對于存在多種型號規格的產品,需明確各型號規格的區別。需采用對比表及帶有說明性文字的圖片、圖表,對各型號、規格的結構組成、功能、產品特征、性能指標等方面進行描述。
醫用氣體報警系統通常由傳感器、顯示面板、控制電路和集中監測與報警管理系統(醫用氣體報警器不包含該組件)組成,是醫用供氣系統的監測部分。
產品結構示例如圖1:
產品結構示例如圖2:
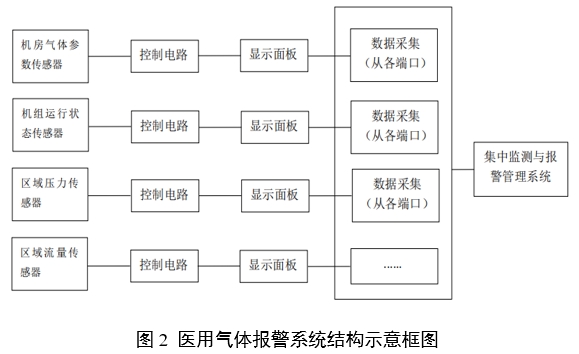
注:上述結構示意圖僅供參考,具體產品結構組成應根據實際情況確定。
注冊申請人需明確監測的氣體種類及參數,提供每個監測參數包含的組成部分及連接示意圖,提供產品完整的示意圖。
需明確報警裝置在醫用氣體系統實際安裝中可能出現的具體位置(如區域報警護士站,氣源報警等)及所包含的報警功能,包含網絡接口的需一并明確。
2.產品工作原理/作用機理
產品工作原理:將傳感器采集到的信號經計算、處理并傳輸至顯示面板和/或集中監測和報警平臺,實現氣體參數的顯示、監測、報警和數據管理等功能。需同時明確傳感器工作原理。
產品作用機理:不適用。
3.產品的適用范圍、禁忌證
3.1適用范圍
用于醫療機構對醫用氣體供應和設備狀況進行監測,需明確監測的氣體種類及參數。氣體種類,如氧氣、93%氧(富氧空氣)、氧化亞氮、氧氣/氧化亞氮混合物、氦/氧混合物、醫用空氣(包括醫療空氣、器械空氣、牙科空氣)、驅動手術器械用氮氣、二氧化碳等;監測參數,如氣體壓力、流量、濃度、露點和設備的運行狀況等。
3.2禁忌證
無。
4.產品的不良事件歷史記錄
注冊申請人應關注并收集同類產品以及申報產品注冊周期內的不良事件歷史記錄,可通過各國監管機構發布的不良事件資料庫中查詢相應不良事件數據。可以產品名稱為方向開展醫療器械不良事件查詢,通過在已選擇的數據庫的檢索頁面輸入預期要進行查詢的醫療器械產品名稱,通過限制檢索時間進行相關產品不良事件信息收集。
可以檢索公開發布的不良事件信息如下:
4.1國家藥品不良反應監測中心發布的“醫療器械不良事件信息通報”及“醫療器械警戒快訊”。
4.2美國不良事件查詢數據庫MAUDE、召回查詢數據庫Recall及按年份查詢警告信(warning letter)。
4.3英國醫療器械警報(MHRA)。
4.4加拿大召回與警戒(Search recalls and safety alerts)。
4.5澳大利亞TGA不良事件(Database of Adverse Event Notifications - medical devices)、召回(System for Australian Recall Actions)及警戒(All alerts)。
4.6日本PMDA。
4.7德國BfArM。
(三)非臨床資料
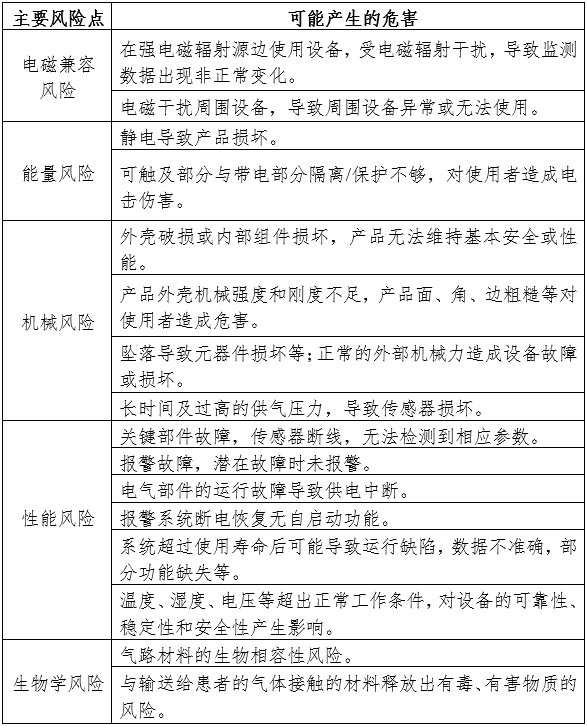
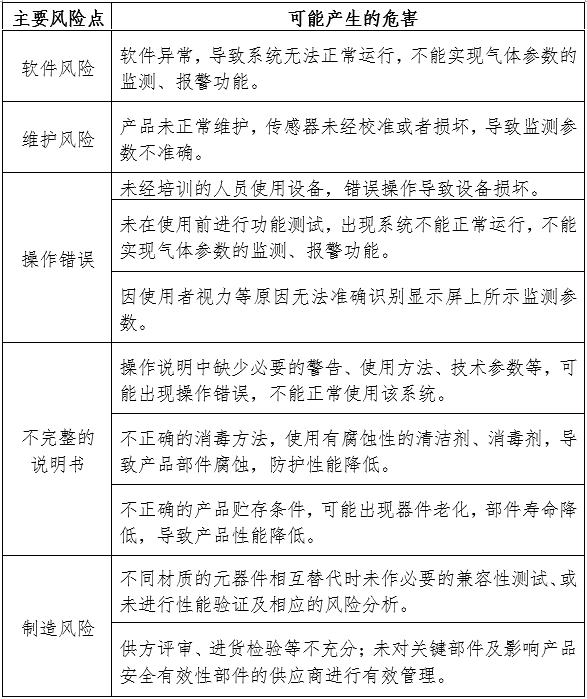
1.產品風險管理資料
風險管理資料應符合GB/T 42062的有關要求,產品主要風險點見附表。
表中所列出的風險點、危害僅為與產品密切相關的部分,并不能代表設備的全部風險。申請人應依據自身的質量管理體系要求,結合產品特點評估相關風險,并建立起科學全面的風險分析與管理制度,進而避免較大程度的風險及危害的發生。
2.產品技術要求
按照《醫療器械產品技術要求編寫指導原則》編制產品技術要求。需明確工作條件,包括電源、大氣壓力、環境溫度、環境濕度等。
不同的醫用氣體報警系統其結構根據設計要求會有所區別。本指導原則列出此類產品可能涉及的重要性能參數,注冊申請人可根據自身產品的技術特點制定性能指標的具體要求。若有相關國家標準和行業標準發布實施的,應符合相應標準要求。
若含有軟件,應按照《醫療器械軟件注冊審查指導原則》的要求,明確軟件名稱、型號規格、發布版本、版本命名規則等。
產品性能指標可能包括但不限于:
2.1監測參數
2.1.1壓力
應明確醫用氣體和/或醫用真空壓力監測范圍及誤差;
2.1.2流量、濃度、露點、溫度等(如適用)
應明確監測范圍及誤差;醫用氧氣計量應具有實時、累計計量功能。
2.2提示、報警功能
2.2.1用于中心吸引站的,需符合YY/T 0186中4.2.4條款要求;用于中心供氧系統的,需符合YY/T 0187中4.4條款要求;
2.2.2氣源報警
壓縮醫用氣體供氣源壓力超出允許壓力上限和額定壓力欠壓15%時,應啟動超、欠壓報警;
2.2.3區域報警
應符合YY 9706.108要求;且壓縮醫用氣體工作壓力超出額定壓力±20%時,應啟動超壓、欠壓報警;
2.2.4視覺報警
應能在距離4m、視角小于30°和100 1x的照度下清楚辨別;操作者的視覺敏銳度為1(如必要,經矯正);區域報警不適用;
2.2.5聽覺報警
在設定條件下應能啟動,1.5m處的聲壓級不應低于55dB(A),并應有聲音暫停功能;區域報警不適用;
2.2.6其他報警功能
如氣體流量、濃度、露點、溫度及運行報警等;
2.3建議執行GB 50751第7章“醫用氣體系統監測報警”中適用的條款要求;
2.4軟件功能
應符合《醫療器械軟件注冊審查指導原則(2022年修訂版)》中第九章注冊申報資料補充說明中關于產品技術要求性能指標的建議內容。
2.5外觀及顯示性能
2.5.1外觀應光滑平整,色澤均勻,無明顯劃痕、毛刺、鋒棱和變形缺陷;
2.5.2顯示面板上圖形符號和字母準確、清晰、均勻,不得有劃痕。
2.6安全要求
電氣安全應符合GB 9706.1標準的要求,電磁兼容性能應符合YY 9706.102標準的要求。
3.同一注冊單元內注冊檢驗代表產品確定原則和實例
檢驗用產品應當能夠代表申請注冊產品的安全性和有效性,應充分考慮產品功能、結構組成、性能指標、適用范圍及其他風險等方面;代表產品應是功能最齊全、結構最復雜、風險最高的產品。
注冊單元內各型號的主要安全指標、性能指標不能被代表型號全部涵蓋時,則應選擇涵蓋安全指標、性能指標最多的產品作為代表產品,同時還應考慮其他型號中未被代表型號所涵蓋的安全指標及性能指標。
與性能和安全項目關注點不同,電磁兼容方面的典型性產品應充分考慮注冊單元內不同型號之間電磁兼容特點和差異。
如:結構相同,僅監測氣體種類、參數不同的醫用氣體報警系統,應選擇監測氣體種類及參數最多、功能最齊全、風險最高的醫用氣體報警系統進行典型型號檢測。
4.研究資料
4.1產品性能研究
應當提供產品性能研究資料以及產品技術要求的研究和編制說明,包括功能性、安全性指標(如電氣安全與電磁兼容)以及與質量控制相關的其他指標的確定依據,所采用的標準或方法、采用的原因及理論基礎。如適用的國家標準、行業標準中有不適用的條款,也應將不適用的條款及理由予以說明。
YY/T 0186是推薦性標準,適用于醫用中心吸引系統產品。對于真空負壓系統的壓力監測需符合4.2.4要求。
YY/T 0187是推薦性標準,適用于醫用中心供氧系統產品。對于供氧系統的壓力監測需符合4.4要求。
GB 50751是強制性國家標準,適用于醫療機構對醫用氣體工程(包含醫用氣體報警系統)設計、施工和驗收。對于GB 50751中的強制性條款,必須嚴格執行。經評估,醫用氣體報警系統沒有適用的強制性條款。根據與產品本身性能的相關性研究,本指導原則列舉了GB 50751中推薦執行的條款,如不適用需明確理由。
ISO7396-1:2016中關于監控和報警系統采納IEC 60601-1-8,故電氣安全建議采納GB 9706.1。部分企業如已采納GB 4793.1和GB/T 18268.1,延續時可直接沿用GB 4793.1和GB/T 18268.1,但首次注冊建議執行GB 9706.1。如ISO 7396-1轉換成國內標準,按最新標準規定執行。
ISO 7396-1:2016對于臨床緊急報警(管道壓力超出額定壓力±20%)的監測和報警信號,需要符合IEC 60601-1-8要求。本指導原則建議區域報警(根據GB 50751,報警分為區域報警和氣源報警)執行IEC 60601-1-8的轉換標準暨YY 9706.108。區域報警器,比如護士站、病房區域氧氣壓力監測的報警器,應符合YY 9706.108要求;而對于氣源報警,只要求按GB 50751和YY/T 0187(僅適用于醫用中心供氧系統)具有相應的報警功能;負壓報警,按GB 50751和YY/T 0186具有相應的報警功能。
4.2燃爆風險
對于暴露于易燃、易爆氣體的組件(如傳感器),應當提供燃爆風險研究資料,證明在正常狀態及單一故障狀態下,燃爆風險可接受。與氧氣接觸的部件,應符合YY/T 0882要求。
4.3生物學特性研究
評價與患者直接或間接接觸部分的生物相容性,如傳感器。建議參照YY/T 1778.1對呼吸氣體通路進行生物學研究。鼓勵有條件的企業根據ISO 18562系列標準評價氣體通路生物相容性。
研究資料應當包括:生物相容性評價的依據和方法,產品所用材料的描述及與人體接觸的性質、材料應用歷史,實施或豁免生物學試驗的理由和論證,對于現有數據、安全使用歷史或試驗結果的評價。
4.4滅菌/消毒工藝研究
終端用戶消毒:如適用,應明確推薦的消毒工藝(方法和參數)以及所推薦消毒方法確定的依據。
4.5軟件研究
應參照《醫療器械軟件注冊審查指導原則(2022年修訂版)》相關要求提交軟件研究報告。
若適用,還應當按照《醫療器械網絡安全注冊查指導原則(2022年修訂版)》要求提交網絡安全研究報告。
4.6聯合使用
如申報產品預期與其他醫療器械、非醫療器械產品聯合使用實現同一預期用途,應當提供證明聯合使用安全有效的研究資料,包括互聯基本信息(連接類型、接口、協議、最低性能)、聯合使用風險及控制措施、聯合使用上的限制、兼容性研究等。
4.7.環境試驗
申請人應按照GB/T 14710的要求提交相關研究資料。檢測項目選取原則為與電氣部分相關的性能指標(如報警裝置對應的相關性能指標)。
4.8證明產品安全性、有效性的其他研究資料
5.穩定性研究
5.1使用穩定性
參見《有源醫療器械使用期限注冊技術審查指導原則》相關要求,應當提供使用穩定性/可靠性研究資料,證明在生產企業規定的使用期限/使用次數內,在正常使用、維護情況下,產品的性能、功能滿足使用要求。
5.2運輸穩定性
應當提供運輸穩定性和包裝研究資料,證明在生產企業規定的運輸條件下,運輸過程中的環境條件(例如:震動、振動、溫度和濕度的波動)不會對醫療器械的特性和性能,包括完整性和清潔度,造成不利影響。
(四)臨床評價資料
該類產品已列入《免于臨床評價醫療器械目錄》(以下簡稱《目錄》),注冊申請人應當按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》,從基本原理、結構組成、性能、安全性、適用范圍等方面,證明產品的安全有效性。無需提交臨床評價資料。
對于不在《目錄》產品描述范圍之內,或不能證明與已獲準境內注冊的產品具有基本等同性,應按相關臨床評價指導原則開展臨床評價。
(五)產品說明書和標簽樣稿
產品說明書和標簽應當符合《醫療器械說明書和標簽管理規定》和GB 9706.1、YY 9706.102、YY 9706.108以及其他適用標準中關于說明書和標簽的相關要求。
說明書還應關注以下內容:
1.產品適用范圍、主要性能指標、軟件發布版本。
2.關于產品安裝的說明,明確按GB 50751進行施工安裝及與產品配合使用的管道接口標準的要求。
3.對于產品使用方法、產品壽命、維護保養等情況的說明。說明與管路接觸部件的定期檢查維護。
4.所有報警信號和信息信號的說明。
5.告知用戶如何連接和斷開可拆卸部件和附件;告知醫療機構醫用氣體報警系統的安裝圖紙。
6.對于電磁兼容所聲稱的有關內容。
7.對于安全性方面的注意事項,包括熔斷器、顯示器及傳感器等更換的潛在風險及安全措施。
8.關于提醒使用者驗收的相關要求。
9.常見故障及排除方法。
(六)質量管理體系文件
生產制造信息
1.應當明確產品生產工藝過程
工藝過程可采用流程圖的形式,并說明其每道工序及接收和放行標準,同時對過程控制要點進行詳細說明。
2.生產場地
應詳細說明產品生產場地地址、生產工藝布局、生產環境要求及周邊情況。有多個研制、生產場地,應當概述每個研制、生產場地的實際情況。
[1]中華人民共和國國務院.醫療器械監督管理條例:中華人民共和國國務院令第739號[Z].
[2]國家市場監管總局.醫療器械注冊與備案管理辦法:國家市場監管總局令第47號[Z].
[3]國家食品藥品監督管理局.醫療器械說明書和標簽管理規定:國家食品藥品監督管理總局令第6號[Z].
[4]國家食品藥品監督管理局.醫療器械通用名稱命名規則:國家食品藥品監督管理總局令第19號[Z].
[5]國家食品藥品監督管理局.醫療器械分類目錄:國家食品藥品監督管理總局公告2017年第104號[Z].
[6]國家食品藥品監督管理局.醫療器械注冊單元劃分指導原則:總局通告2017年第187號[Z].
[7]國家藥品監督管理局.有源醫療器械使用期限注冊技術審查指導原則:國家藥品監督管理局通告2019年第23號[Z].
[8]國家藥品監督管理局醫療器械審評中心.醫療器械網絡安全注冊審查指導原則(2022年修訂版):國家藥監局器審中心通告2022年第7號[Z].
[9]國家藥品監督管理局醫療器械審評中心.醫療器械軟件注冊審查指導原則(2022年修訂版):國家藥監局器審中心通告2022年第9號[Z].
[10]國家藥品監督管理局.列入免于臨床評價醫療器械目錄產品對比說明技術指導原則:國家藥監局通告2021年第73號[Z].
[11]國家藥品監督管理局.免于臨床評價醫療器械目錄:國家藥監局通告2021年第71號[Z].
[12]YY/T 1778.1-2021,醫療應用中呼吸氣體通路生物相容性評價 第1部分:風險管理過程中的評價與試驗[S].
[13]GB/T 42062-2022,醫療器械風險管理對醫療器械的應用[S].
[14]GB/T 14710-2009,醫用電器環境要求及試驗方法[S].
[15]GB 50751-2012,醫用氣體工程技術規范[S].
[16]YY 9706.108-2021,醫用電氣設備 第1-8部分:基本安全和基本性能的通用要求 并列標準:通用要求,醫用電氣設備和醫用電氣系統中報警系統的測試和指南[S].
[17]GB 9706.1-2020,醫用電氣設備 第1部分:基本安全和基本性能的通用要求[S].
[18]YY 9706.102-2021,醫用電氣設備 第1-2部分:基本安全和基本性能的通用要求 并列標準:電磁兼容 要求和試驗[S].
[19]GB 4793.1-2007,測量、控制和實驗室用電氣設備的安全要求 第1部分:通用要求[S].
[20]GB/T 18268.1-2010,測量、控制和實驗室用的電設備電磁兼容性要求 第1部分:通用要求[S].
[21]ISO 7396-1, Medical gas pipeline systems - Part 1: Pipeline systems for compressed medical gases and vacuum[S].
[22]ISO 18562系列,醫療應用中呼吸氣體通路生物相容性評價[S].
附表

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《

2024年10月19日,在第 75 屆世界醫學會全體大會上正式通過了《赫爾辛基宣言》的最新修訂版本;《赫爾辛基宣言》作為人類參與者的醫學研究倫理

附件:血液透析用水處理設備注冊審查指導原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設備注冊審查指導原則(2024年修訂版)本指導原則旨在指導注冊申請人對血液透析用水處理設備注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對血液透析用水處理設備的一般要求,注冊申請人依據產品的具體特性確定其中內容是否適用。若不適用,要具體闡述理由及相應的科學依據,并依據產

本指導原則旨在幫助和指導注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術審評的基本要求。同時有助于審評機構對該類產品進行科學規范的審評,提高審評工

國家藥監局關于發布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據

國家藥監局藥審中心關于發布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發布日期:20241010

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管

國家藥監局器審中心關于發布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發布時間:2024-10-14為進一步規范

附件:醫用透明質酸鈉創面敷料注冊審查指導原則(2024年第21號).doc醫用透明質酸鈉創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫醫用透明質酸鈉創面敷料注冊申報資料,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對醫用透明質酸鈉創面敷料產品的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
