長江三角洲區域醫療器械注冊人制度試點工作實施方案(試行)(滬藥監械管〔2019〕112號)
為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械
來源:醫療器械注冊代辦 發布日期:2024-05-27 閱讀量:次
附件:電動攝影平床注冊審查指導原則(2024年第19號).doc
本指導原則旨在指導注冊申請人對電動攝影平床注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。
本指導原則是對電動攝影平床的一般要求,申請人應依據產品的具體特性確定其中的內容是否適用。若不適用,需具體闡述其理由及相應的科學依據,并依據具體的產品特性對注冊申報資料的內容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件,但不包括注冊審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。如果有能夠滿足相關法規要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的,隨著法規和標準的不斷完善,以及科學技術的不斷發展,相關內容也將適時進行調整。
本指導原則適用于電動攝影平床的產品注冊。按現行《醫療器械分類目錄》,該類產品分類編碼為06-05-03,管理類別為Ⅱ類。X射線攝影(診斷)設備中所含電動攝影平床可參照本指導原則執行。
(一)監管信息
明確申請表中產品名稱、管理類別、分類編碼、型號規格、產品組成等信息。
1.產品名稱
產品命名需符合《醫療器械通用名稱命名規則》和《醫用成像器械通用名稱命名指導原則》的要求。根據產品預期用途可采用電動攝影平床進行命名。
2.分類編碼
依據《醫療器械分類目錄》,申報產品分類編碼為06-05-03。
3.注冊單元劃分
注冊單元劃分原則上以產品的技術原理、結構組成、性能指標和適用范圍為劃分依據。電動攝影平床注冊單元劃分建議重點關注以下幾個方面:
3.1結構組成:
固定式電動攝影平床與移動式電動攝影平床應劃為不同注冊單元。
帶有X射線管組件支撐裝置的電動攝影平床與不帶X射線管組件支撐裝置的電動攝影平床應劃為不同注冊單元。
3.2適用范圍:
用于X射線攝影成像患者的支撐的電動攝影平床與包含其他用途的電動攝影平床不能劃為同一注冊單元。
(二)綜述資料
1.產品描述
1.1器械及操作原理描述
1.1.1工作原理
需詳述產品的工作原理,例如:電動攝影平床通過電力驅動,控制平床垂直升降、平床水平橫向移動、平床縱向移動、平床轉動,輔助患者進行攝影成像檢查擺位;含X射線源組件支撐裝置的電動攝影平床還可以控制X射線管組件垂直升降、X射線管組件水平縱向移動以及X射線管組件水平旋轉,輔助攝影成像源像距調整。
1.1.2結構組成
電動攝影平床通常由床身、床面板、支撐裝置、探測器或暗盒托盤、電力驅動裝置、控制部分組成,可能還會包括X射線源組件支撐裝置。移動式電動攝影平床還會包含腳輪。
產品結構示例見圖1和圖2:
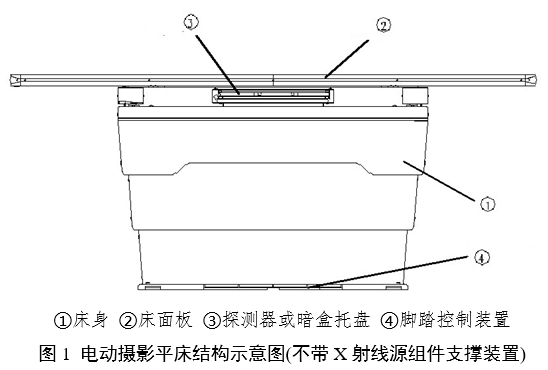
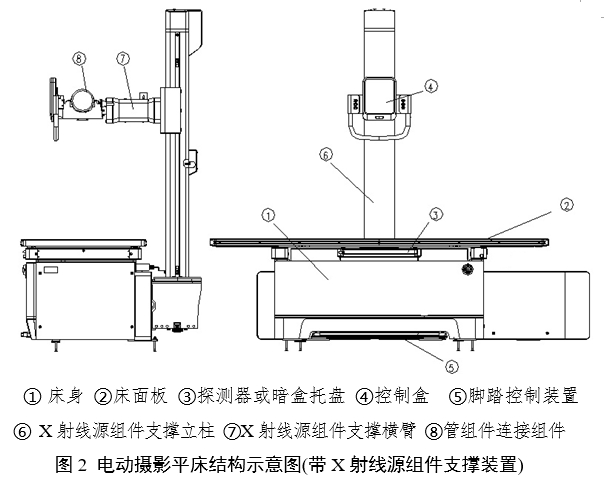
注:上述結構示意圖僅供參考,具體產品結構組成應根據實際產品確定,并提供圖示說明。
1.2型號規格
需明確申報產品的型號規格。如同一個注冊單元包含多個型號規格,應列表說明各型號之間的異同。
2.適用范圍和禁忌證
2.1適用范圍
適用范圍需根據臨床實際應用情況確定,例如用于X射線攝影成像中對患者的支撐。
2.2預期使用環境
需明確設備預期使用場所和使用環境要求。該產品通常在醫療機構使用。預期使用環境的信息應當明確可能影響其安全性和有效性的環境條件,如溫度、濕度、壓力、移動、振動、海拔等。
(三)非臨床資料
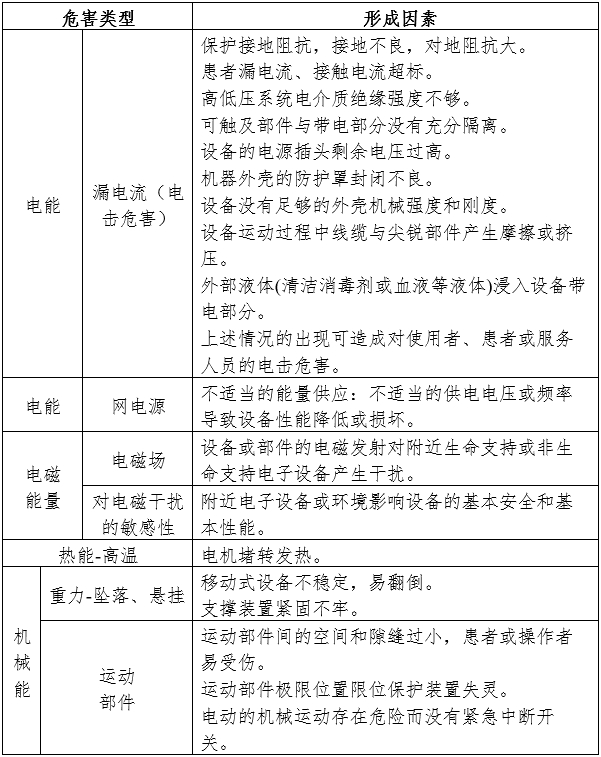
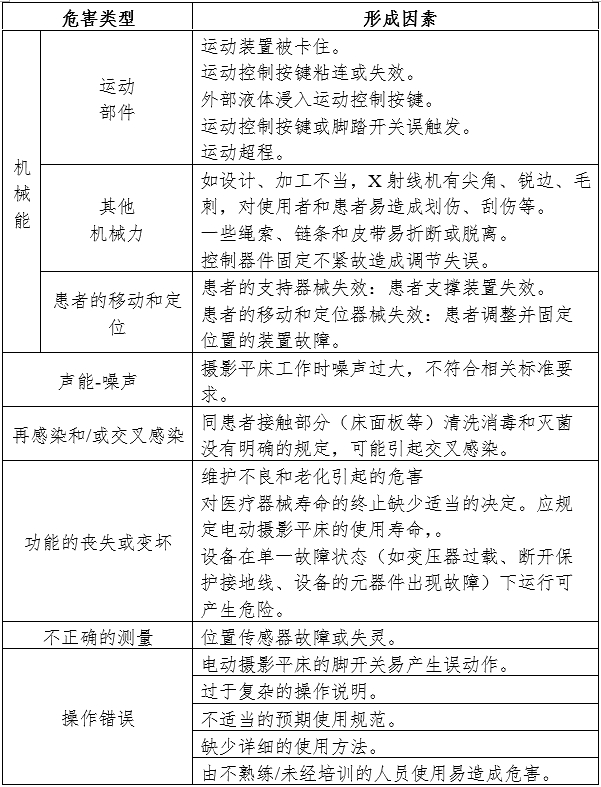
1.產品風險管理資料
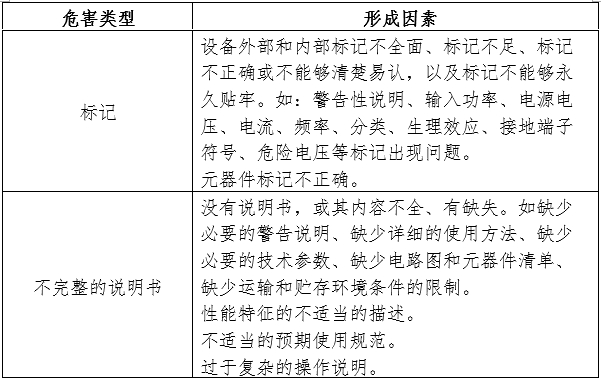
應符合GB/T 42062《醫療器械風險管理對醫療器械的應用》,以下依據GB/T 42062《醫療器械風險管理對醫療器械的應用》附錄C,提示性列舉了電動攝影平床的可能存在的初始危害因素,見附件。
2.醫療器械安全和性能基本原則清單
參考《醫療器械安全和性能基本原則符合性技術指南》的要求,明確《醫療器械安全和性能基本原則清單》中各項要求的適用性。對于不適用的要求,應當逐項說明不適用的理由。對于適用要求,應逐項說明為符合要求所采用的方法,以及證明其符合性的文件。關于證明各項要求符合性的文件,如果包含在產品注冊申報資料中,應當說明其在申報資料中的具體位置。對于未包含在產品注冊申報資料中的文件,應當注明該證據文件名稱及其在質量管理體系文件中的編號。
3.產品技術要求及檢驗報告
3.1產品技術要求
注冊申請人應按照《醫療器械產品技術要求編寫指導原則》編寫產品技術要求,結合申報產品的特點設置條款。
產品如包含軟件組件要注明軟件發布版本、軟件版本命名規則,其中軟件版本命名規則需與質量管理體系保持一致。
本指導原則列出了電動攝影平床可能涉及的主要技術指標:
3.1.1床面高度
床面高度應符合YY/T 0737標準的要求。
3.1.2床面水平移動性能(如適用)
應規定床面水平橫向及縱向移動范圍及其偏差;床面移動應平穩。
3.1.3床面垂直升降性能(如適用)
應規定床面垂直升降范圍及其偏差;床面移動應平穩。
3.1.4床身轉動性能(如適用)
應規定床身轉動角度范圍及其偏差;床面轉動應平穩。
3.1.5X射線源組件支撐裝置(如適用)
帶有X射線源組件支撐裝置的電動攝影平床,產品技術要求應規定X射線源組件支撐裝置沿床面縱向和垂直方向移動范圍。
3.1.6床面板
床面板應無妨礙X射線診斷的陰影,同時應規定床面板的衰減當量。
3.1.7濾線器(如適用)
濾線器應符合YY/T 0737標準的要求。
3.1.8床面承重
床面承重應符合YY/T 0737標準的要求。
3.1.9長度指示值
應規定長度指示值與實際值的偏差。
3.1.10角度指示值
應規定角度指示值與實際值的偏差。
3.1.11啟動力
在連續X射線輻射狀態下,需要人力操作的運動部分的啟動力應不大于50N。
3.1.12直線運動部分制動力
機械裝置中的運動部分應有制動裝置(懸掛裝置中要求隨遇平衡不需要制動的除外),直線運動部分制動力應不小于100N。
3.1.13旋轉運動部分制動力(如適用)
旋轉運動部分的制動力應在產品技術要求中規定。
3.1.14電力驅動運動部分
電力驅動運動部分應符合YY/T 0737標準的要求。
3.1.15控制盒(如適用)
控制盒的要求應在產品技術要求中規定,如操作功能、顯示方式等。
3.1.16腳踏開關(如適用)
腳踏開關應符合YY/T 1057標準的要求(除4.1.2外)。
注:申請人可以規定YY/T 1057標準的4.1.2 工作電阻的要求。
3.1.17外觀
外觀應符合YY/T 0737標準的要求。
3.1.18安全
應符合GB 9706.1、GB 9706.103、GB 9706.254、YY 9706.102的要求。
3.2檢驗報告
檢驗產品典型性:檢驗用典型型號產品應是功能最齊全、結構最復雜、風險最高的產品,應充分考慮產品結構組成、性能指標、安全指標及其他風險等方面。如果典型型號產品不能覆蓋其他型號的全部性能指標和安全指標,則可對不能覆蓋的部分指標進行差異檢測。
4.產品性能研究
應當提供產品性能研究資料以及產品技術要求的研究和編制說明,包括功能性、安全性指標(如電氣安全與電磁兼容)以及與質量控制相關的其他指標的確定依據,所采用的標準或方法、采用的原因及理論基礎。如適用的國家標準、行業標準中有不適用的條款,也應將不適用的條款及理由予以說明。
具體如下:
4.1化學和物理性能研究
性能指標確定的依據應根據產品的工作原理描述設計輸入來源以及臨床意義,明確申報產品所采用的標準或方法、采用的原因及理論基礎。適用的國家標準、行業標準中,如果有不適用的條款,也應將不適用的條款及理由予以說明。
產品性能指標的確定依據應明確、具體,并應描述其所考慮的實際臨床應用出發點,以及相關指標和臨床使用的關聯性,不能籠統地描述為“依據產品特點”“依據臨床需求確定”,應詳細說明是產品的什么特點,何種臨床需求。對于參考同類產品確定的,應提供同類產品的相關資料。
申報產品預期與其他醫療器械產品聯合使用實現對患者的攝影診斷。應當提供證明聯合使用安全有效的研究資料,包括互聯基本信息(連接類型、接口、協議、最低性能)、聯合使用風險及控制措施、聯合使用上的限制,兼容性研究等。
申報產品若同時具備其他功能,應提交詳細資料說明工作原理并提交相應的驗證資料。
4.2電氣系統安全性研究
應提供電氣安全性、機械和環境保護以及電磁兼容性的研究資料,說明適用的標準以及開展的研究。若適用的強制性標準中有不適用的條款,還應說明不適用理由。
4.3軟件研究
申報產品若包含軟件組件,需參照《醫療器械軟件注冊審查指導原則(2022年修訂版)》和《醫療器械網絡安全注冊審查指導原則》(如適用)的相關要求提交產品軟件研究資料。
4.4生物學特性研究
生物相容性評價資料應明確接觸部件名稱、患者接觸類型、患者接觸時間、患者接觸材料名稱。應對產品中與患者直接接觸或間接接觸的材料進行生物學評價。按照GB/T 16886.1標準要求,至少考慮以下方面的要求:細胞毒性、致敏性。
4.5清潔和消毒研究
應當明確推薦的清洗和消毒工藝(方法和參數)、工藝的確定依據以及驗證的相關研究資料。
4.6使用穩定性
申請人可以參考《有源醫療器械使用期限注冊技術審查指導原則》,提供產品使用期限的研究資料。
4.7運輸穩定性
申請人需提供運輸穩定性和包裝研究資料,證明在規定的運輸條件下,運輸過程中的環境條件不會對醫療器械的造成不利影響。運輸穩定性可參考YY/T 0291標準的要求進行。
4.8其他資料
該產品列入《免于臨床評價醫療器械目錄》,需按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》的要求開展等同性論證。若無法證明申報產品與《免于臨床評價醫療器械目錄》所述的產品具有基本等同性,應按照《醫療器械臨床評價技術指導原則》的要求提交臨床評價資料。
(四)產品說明書和標簽樣稿
產品說明書和標簽應當符合《醫療器械說明書和標簽管理規定》及相關國家標準、行業標準中有關產品使用說明書及標簽的要求。
應規定電動攝影平床的電源條件;警告及注意事項應包括產品使用人員的要求,如需由經過培訓的專業的醫務人員操作;應規定電磁兼容方面相關的警告及措施;應包含不應放置在影響本產品運行和性能的位置的警告;應規定對產品進行消毒后,室內應充分換氣再接通裝置電源,如室內殘留易燃性氣體,通電時有可能產生火災和爆炸;應規定將患者往攝影平床上固定時,務必確認手腳、頭發,衣服等沒露出攝影平床外;應規定如沒有正確將患者固定,患者身體的某個部位有夾在攝影平床下面的風險,一旦發生患者有可能受傷;應規定患者無意識時,為防止從攝影平床上跌落,應采取固定措施;應規定使用產品前需確認牢固安裝了患者支架附屬品,如果沒有牢固安裝,有可能導致附屬品脫落,裝置損壞,患者受傷;應規定使用產品前需確認患者導尿管和尿袋的安全性,防止尿液濺到攝影平床上,造成漏電等事故。
安裝和調試應包括電源的選擇、地線的埋設、機器的布局、通電試驗及性能調試部分,必要時應有安裝示意圖。
使用方法應包括控制部分的詳細描述、操作的順序和步驟、產品功能的描述以及對控制面板上所出現的圖形符號的解釋和說明。
X射線防護的相關內容應符合GB 9706.103中關于隨機文件的有關要求(標準5.2.1條款的表2),具體包括正常使用時焦點到影像接收器的距離(若包含X射線管組件支撐裝置)、床面板及附件最大衰減當量的說明等。
維護和保養應包括產品的清潔消毒方式及相關注意事項;日檢、周檢和年檢的內容;設備維修人員的資質要求。
故障排除應包括使用中如果發生異常聲響、操作失靈、設備損壞、攝影平床運動不受控制等情形下的處理方式。
[1]中華人民共和國國務院.醫療器械監督管理條例:中華人民共和國國務院令第739號[Z].
[2]國家市場監督管理總局.醫療器械注冊與備案管理辦法:國家市場監督管理總局令第47號[Z].
[3]國家食品藥品監督管理局.醫療器械說明書和標簽管理規定:國家食品藥品監督管理總局令第6號[Z].
[4]國家食品藥品監督管理局.醫療器械通用名稱命名規則:國家食品藥品監督管理總局令第19號[Z].
[5]國家藥品監督管理局.醫用成像器械通用名稱命名指導原則:國家藥監局通告2020年第41號[Z].
[6]國家食品藥品監督管理局.醫療器械分類目錄:國家食品藥品監督管理總局公告2017年第104號[Z].
[7]國家食品藥品監督管理局.醫療器械注冊單元劃分指導原則:總局通告2017年第187號[Z].
[8]國家藥品監督管理局.有源醫療器械使用期限注冊技術審查指導原則:國家藥品監督管理局通告2019年第23號[Z].
[9]國家藥品監督管理局醫療器械審評中心.醫療器械軟件注冊審查指導原則(2022年修訂版):國家藥監局器審中心通告2022年第9號[Z].
[10]國家藥品監督管理局.列入免于臨床評價醫療器械目錄產品對比說明技術指導原則:國家藥監局通告2021年第73號[Z].
[11]國家藥品監督管理局.免于進行臨床評價醫療器械目錄(2023年):國家藥監局關于發布免于臨床評價醫療器械目錄通告2023年第33號[Z].
[12]國家藥品監督管理局.醫療器械產品技術要求編寫指導原則:國家藥監局公告2022年第8號[Z].
[13]國家藥品監督管理局.醫療器械注冊申報資料要求和批準證明文件格式:國家藥監局公告2021年第121號[Z].
[14]國家藥品監督管理局醫療器械審評中心.醫療器械安全和性能基本原則符合性技術指南:國家藥監局器審中心通告2022年第29號[S].
[15]GB/T 16886.1-2022,醫療器械生物學評價第1部分:風險管理過程中的評價與試驗[S].
[16]GB/T 42062-2022,醫療器械風險管理對醫療器械的應用[S].
[17]GB 9706.1-2020,醫用電氣設備 第1部分:基本安全和基本性能的通用要求[S].
[18]GB 9706.103-2020,醫用電氣設備 第1-3部分:基本安全和基本性能的通用要求 并列標準:診斷X射線設備的輻射防護[S].
[19]GB 9706.254-2020,醫用電氣設備 第2-54部分:X射線攝影和透視設備的基本安全和基本性能專用要求[S].
[20]GB/T 10149-1988,醫用X射線設備術語和符號[S].
[21]GB/T 5465.2-2023,電氣設備用圖形符號[S].
[22]YY 9706.102-2021,醫用電氣設備 第1-2部分:基本安全和基本性能的通用要求 并列標準:電磁兼容 要求和試驗[S].
[23]GB/T 191-2008,包裝儲運圖示標志[S].
[24]YY/T 0737-2009,醫用X射線攝影床專用技術條件[S].
[25]YY/T 1057-2016,醫用腳踏開關通用技術條件[S].
[26]YY/T 1099-2007,醫用X射線設備包裝、運輸和貯存 [S].
[27]YY/T 0291-2016,醫用X射線設備環境要求及試驗方法[S].
[28]YY/T 0466.1-2023,醫療器械 用于醫療標簽、標記和提供信息的符號 第1部分:通用要求[S].
[29]YY/T 0106-2021,醫用診斷X射線機通用技術條件[S].
[30]YY/T 0741-2018,數字化攝影X射線機專用技術條件[S].
[31]YY/T 0742-2021,胃腸X射線機專用技術條件[S].
附件

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

為深入貫徹落實中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),按照國家藥品監督管理局《關于擴大醫療器械

為規范醫療器械注冊人跨區域委托生產的監督管理,推進長江三角洲區域醫療器械跨區域監管,根據《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》《

2024年10月19日,在第 75 屆世界醫學會全體大會上正式通過了《赫爾辛基宣言》的最新修訂版本;《赫爾辛基宣言》作為人類參與者的醫學研究倫理

附件:血液透析用水處理設備注冊審查指導原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設備注冊審查指導原則(2024年修訂版)本指導原則旨在指導注冊申請人對血液透析用水處理設備注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對血液透析用水處理設備的一般要求,注冊申請人依據產品的具體特性確定其中內容是否適用。若不適用,要具體闡述理由及相應的科學依據,并依據產

本指導原則旨在幫助和指導注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術審評的基本要求。同時有助于審評機構對該類產品進行科學規范的審評,提高審評工

國家藥監局關于發布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據

國家藥監局藥審中心關于發布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發布日期:20241010

國家市場監督管理總局令 第47號 《醫療器械注冊與備案管理辦法》已經2021年7月22日市場監管總局第11次局務會議通過,現予公布,自2021年10月1日起施行。 附件: 醫療器械注冊與備案管

國家藥監局器審中心關于發布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發布時間:2024-10-14為進一步規范

附件:醫用透明質酸鈉創面敷料注冊審查指導原則(2024年第21號).doc醫用透明質酸鈉創面敷料注冊審查指導原則本指導原則旨在指導注冊申請人準備及撰寫醫用透明質酸鈉創面敷料注冊申報資料,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對醫用透明質酸鈉創面敷料產品的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
