有源醫療器械加速老化試驗效期驗證及使用期限驗證流程
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有
來源:醫療器械注冊代辦 發布日期:2024-08-16 閱讀量:次

印度尼西亞是一個擁有2.755億人口的亞洲發展中國家,是世界上人口第四多的國家。該國的藥品市場是東南亞國家聯盟(東盟)國家中最大的,總規模約為33億美元,年增長率為10%-14%。在過去的二十年里,印度尼西亞的醫療基礎設施也經歷了顯著增長,醫生、醫院和初級衛生保健設施的數量都大幅增加。
與其他發展中經濟體一樣,隨著傳染病發病率呈下降趨勢,而非傳染性疾病發病率和死亡率呈上升趨勢,印度尼西亞的疾病負擔正在發生變化。雖然印度尼西亞仍然有很高的傳染病負擔,包括瘧疾、結核病和登革熱,但該國在防治這些疾病方面取得了很大進展。例如,2015年至2019年,印度尼西亞的瘧疾病例從110萬減少到65.9萬,據估計,印度尼西亞75%的人口現在生活在無瘧疾社區。在過去兩年中,印度尼西亞在結核病檢測和報告方面也取得了重大改進,他們目標是到2030年將結核病發病率降至每10萬人口65例。與此同時,慢性疾病比如心血管疾病,腫瘤,和糖尿病現在也成為了印度尼西亞的主要健康負擔和主要死亡原因。
印度尼西亞的臨床試驗歷史已經超過了20多年。在新冠肺炎大流行期間,臨床研究的步伐加快了,當時印度尼西亞改進了監管審批程序,將研究啟動時間從大流行的大約兩年縮短到了六到九個月。
因此,新冠肺炎疫苗的幾項大規模臨床試驗在全國各地進行,證明了印度尼西亞有能力進行高質量的多國臨床試驗(即由印度尼西亞進行并涉及全球其他國家的研究)。事實上,目前正在進行的跨國臨床試驗的數量超過了單個國家(僅印度尼西亞)的臨床試驗數量。
盡管如此,但與其他東盟國家相比,印度尼西亞開展的臨床試驗較少,特別是工業界發起的臨床試驗更少。造成這種情況的一些原因可能包括:
---與臨床試驗能力相關的不確定性(例如,當地研究人員的可獲得性、專業知識水平和特定技能)。
---不熟悉印度尼西亞的研究啟動和監管要求/審批時限。
---與血液樣本和/或標本出口的生物樣本轉移協議(MTA)要求相關的挑戰。
令人鼓舞的是,包括印度尼西亞衛生部(MOH)最近承諾推動該國的臨床研究產業,表明該國有很大的潛力成為區域乃至全球臨床研究的領導者。反過來,這一領域的進步有望改善印度尼西亞的人民和醫療保健結果,同時也推動了全球的臨床研究。
根據Trialtrove 2018年1月至2023年11月的數據,印度尼西亞的大多數跨國和本國臨床試驗都是由學術機構發起的(分別為52%和54%),其次是工業界(21%和17%)和政府部門(9%和6%)。各種試驗類型的治療重點大致相似,前五名是感染性疾病、代謝/內分泌學、傳染病疫苗、中樞神經系統和自身免疫/炎癥臨床試驗。其他感興趣的治療領域包括心血管、腫瘤學、眼科和泌尿生殖系統疾病。
2018年1月至2023年11月,跨國和本國的臨床試驗大多數是后期臨床試驗,包括大量的IV期試驗。隨著印度尼西亞的臨床試驗經驗不斷增加,并改善啟動時間,將早期研究帶到印度尼西亞對申辦方越來越具有吸引力。
根據對臨床試驗數據庫記錄的觀察性研究,印度尼西亞臨床研究的目標患者群體主要是成年人(18歲及以上)。對于國際多中心臨床試驗來說尤其如此。與MRCT相比,區域臨床研究中發現,針對弱勢患者群體的臨床研究比例更高,包括兒童(1-18歲)、嬰兒(1歲以下)、老年人(50歲以上)和孕婦。
作為一個人口眾多的國家,印度尼西亞在罕見病臨床試驗方面也有潛在的未開發機會。用于罕見病臨床試驗的兩個重要資源包括印度尼西亞國家罕見病基金會和國家生物醫學基因組科學倡議(NBGSi)內新成立的罕見病研究政府中心。
令人鼓舞的跡象表明,印度尼西亞政府正在采取有意義的措施來支持其臨床試驗行業。例如,2023年7月,衛生部簽署了一項法令,成立了印度尼西亞國家臨床研究中心(INA-CRC)。
其職能是協調和促進所有醫院的臨床試驗,作為加快印尼衛生研究實施的催化劑。根據這項規定,政府要求每家醫院建立一個臨床研究單位,并參與能力建設活動。這一要求的目的是確保醫院為作為臨床試驗場所做好充分準備。
該法令旨在提高醫院的研究能力,從而在國家和全球范圍內促進醫學科學和患者護理的發展。印度尼西亞還實施了GCP,并要求所有臨床研究人員按照衛生部和BPOM的規定獲得GCP認證。此外,國家醫院、教學醫院、幾所國家頂級醫學院成立了倫理委員會,隨后獲得了國家衛生研究與發展倫理委員會和亞洲及太平洋倫理審查委員會論壇的認證。
然而,印度尼西亞仍然需要更多的資金和投資,特別是在與基礎設施發展、能力建設和研究補助金有關的領域。投資于最先進的研究設施和尖端技術,包括用于研究的臨床實驗室,不僅可以提高臨床研究單位的能力,還可以吸引國際合作和投資。
此外,加強對公共和私營部門利益相關者的研究資助和激勵措施,可以刺激創新,推動新型療法和醫療器械的發展。通過簡化審批流程和透明的指導方針營造有利的監管環境,將鼓勵制藥公司和學術機構更多地參與印度尼西亞境內的臨床試驗。
印尼似乎正處于發展成為東南亞卓越的臨床研究中心的關鍵時刻。申辦方有機會從印度尼西亞不斷增長的臨床研究能力中受益(并為此做出貢獻),同時也可以接觸到印度尼西亞龐大而多樣化的人口。印度尼西亞也是進行某些臨床研究(如生物仿制藥)、迫切需要的生物產品(如疫苗)以及利用尖端技術的醫療產品和設備的理想市場,這些產品和設備可能更有可能在印度尼西亞上市,因為目前幾乎沒有競爭。
印度尼西亞衛生部的NBGSi正在通過精準醫療徹底改變印度尼西亞的醫療保健。NBGSi目前正在從九家醫院收集基線基因組學數據,這些醫院專注于傳染病(結核病)、癌癥、腦和神經退行性疾病(最初專注于中風)、代謝性疾病(首先專注于糖尿病)、牛皮癬、罕見病(特別專注于杜氏肌營養不良和肺動脈高壓)、孕產婦和兒童健康以及心血管疾病,為根據印度尼西亞不同的遺傳環境進行個性化醫療奠定了重要基礎。
在任何國家,當地監管環境都會對臨床試驗的數量及其進行方式產生重大影響。在印度尼西亞,一個值得注意的例子是,衛生部于2009年9月頒布了一項法令,要求在將生物樣本運出該國之前要進行MTA(生物樣本轉運協議),例如送往國際多中心試驗中常用的中央實驗室。值得注意的是,MTA并非印尼獨有——例如,中國也有這樣的要求,該國通過建立自己的中央實驗室幫助申辦方管理。
雖然最初MTA法令確實對印度尼西亞進行的國際多中心試驗產生了負面影響,但此后的實際經驗表明,MTA要求可能比預期的障礙要小,平均可以在一兩個月內實現。此外,衛生部目前正在修訂MTA法令,目的是使要求和審批過程更簡單、更透明,這反過來應有助于增強申辦方的信心,加快時間表。
促進研究啟動、加快時間表、提高臨床試驗交付的可預測性以及促進臨床試驗的多樣性和包容性,在很大程度上取決于是否存在經驗豐富的成熟臨床研究機構。這種水平的臨床研究能力在印度尼西亞尚未廣泛普及。
馬來西亞臨床研究(CRM)組織和印度尼西亞之間的合作正在積極討論中。CRM成立于2012年,旨在為支持國家層面的臨床研究提供堅實的基礎,包括為馬來西亞各地的研究醫院提供研究協調員,并將馬來西亞轉變為全球臨床試驗中心。自成立以來,CRM的存在為馬來西亞臨床研究的顯著增長做出了貢獻。
因此,它是印度尼西亞需要支持有利于高質量臨床研究的環境的國家級管理的榜樣。來自雅加達-塞拉坦Mayapada醫院的印度尼西亞代表參加了2024年5月的CRM Connect會議,并訪問了吉隆坡的兩家醫院,觀察和了解馬來西亞醫院如何進行臨床試驗。
新加坡臨床研究所(SCRI)是國家學術臨床研究機構,旨在通過發展臨床研究的核心能力、基礎設施和科學領導力來提高新加坡的臨床研究標準。SCRI于2024年3月與ONWARD Health Research簽署了一份諒解備忘錄(MOU),為在印度尼西亞培養臨床研究協調員(CRC)人才的合作打開了大門。該諒解備忘錄旨在加深對新加坡和印度尼西亞醫療保健研究格局的理解,并確定潛在的合作領域,例如調整SCRI學院的培訓計劃,以進一步提高印度尼西亞CRC的技能。
在鄰國取得成功的基礎上,印度尼西亞的目標是成為臨床研究的主要區域目的地。INA-CRC致力于成為推動全國臨床研究的領導力量。INA-CRC注重合作,旨在簡化流程,提高標準,促進臨床研究的創新。通過戰略伙伴關系和能力建設舉措,INA-CRC尋求促進印度尼西亞臨床研究領域的增長,推動科學進步,改善醫療服務,并在全國范圍內提高患者的治療效果。
得益于眾多監管和能力建設舉措,以及涉及行業和學術部門的區域合作,印度尼西亞作為多區域和區域層面的卓越研究中心的前景一片光明。這對印度尼西亞人民來說是個好消息,他們將受益于更多地獲得解決國家健康問題的新療法,以及該國整體醫療保健系統的進一步發展。
這對申辦方來說也是個好消息,他們對全球研究能力的需求正在增加,同時也需要增加臨床試驗的多樣性和代表性。印度尼西亞是多種研究的理想市場,包括急需的疫苗和兒科營養臨床試驗,以及利用尖端技術的醫療產品和設備,特別是將在該國上市的產品。印度尼西亞衛生部的NBGSi正在努力通過針對印度尼西亞多樣化的遺傳景觀量身定制的精準醫學來徹底改變印度尼西亞的醫療保健。
文章來源:Applied Clinical Trial, June 17, 2024
文章作者:Lena Low; Martin Lim; Terttu Haring; Serena Chan; David Gebbo; Lucia Rizka Andalucia; Roy Himawan; Indri Rooslamiati; Dona Arlinda

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
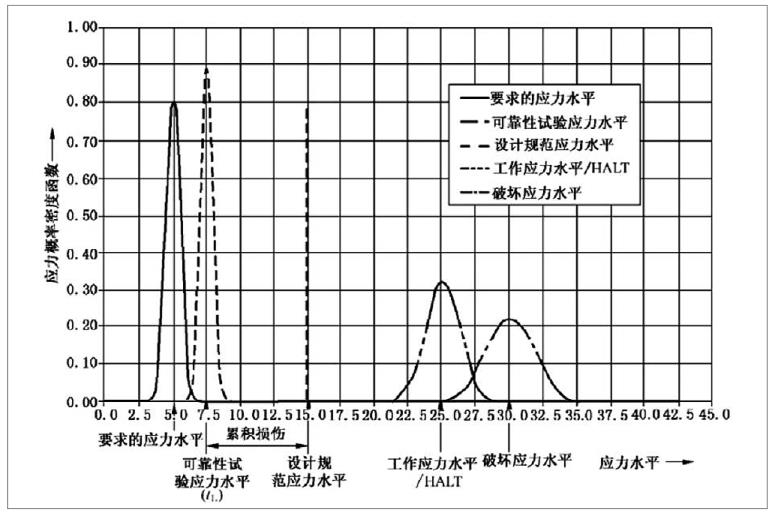
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有

在臨床過程中,異常值指檢測值超出了實驗室的正常值范圍。 有臨床意義(clinical significance,CS) 指檢查數值和正常標準值有差異,對臨床疾病的診斷具有一定的參考價值,而 無臨床

簡述了中藥新藥臨床試驗主要特點,指出要重視風險、受益評估,重視人 用經驗選擇科學、客觀、合適的有效性指標,做好中醫證候療效評價,鼓勵在中藥新藥臨床研究中采用電子化手

按照中共中央辦公廳和國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)和《國務院關于修改〈醫療器械監督管理條例〉的決定》(

盡管處在一個快速發展的陽光產業,在機會面前中國CRC也面臨著很多挑戰,這些挑戰大致可以包括:工作強度大、任務重、壓力大;協調工作難度大,不可控因素多;工作繁雜,工作交

體外診斷試劑臨床試驗數據造假行為,怎么處罰?本文針對體外診斷試劑注冊環節的臨床試驗數據造假行為,一起來看看懲罰力度。
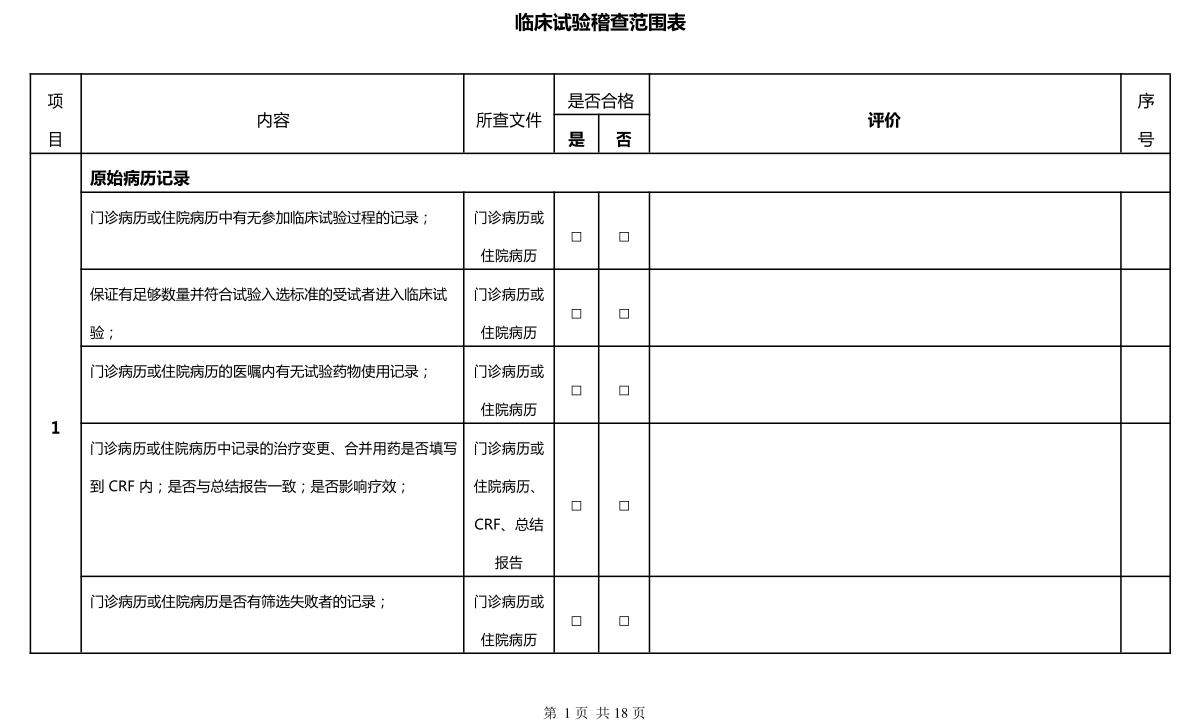
臨床試驗第三方稽查公司不少,思途就是其中之一。在稽查時,相關人員要明確稽查范圍,讓臨床試驗更真實化、合規化。本文將思途在給客戶做稽查時的稽查表分享出來,文末供下載

為進一步規范體外診斷試劑的管理,國家藥監局器審中心組織制定了《人類SDC2基因甲基化檢測試劑臨床試驗資料技術審評要點》、《異常凝血酶原測定試劑臨床試驗資料技術審評要點》

盲法可以避免臨床試驗過程中由于受試者、研究者以及結局評價者等參與者的主觀因素所導致的偏倚。在實際臨床試驗中,盲法通過對研究藥物進行編碼來實現,即通常所稱的藥物編盲

3月13日,西門子醫療Corindus途靈?最新一代CorPath?GRX介入手術機器人在海南博鰲超級醫院完成其國內首例機器人輔助下冠狀動脈介入治療(PCI)手術,手術由中國科學院院士、復旦大學附
行業資訊
知識分享
