臨床崗位科普|CRA/CTA/CRC/CRO/DM/PV/RA是什么意思?
大多數剛畢業的同學在準備進入臨研圈的時候,一定會被鋪天蓋地的行業專有名詞搞得暈頭轉向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請問貴司CEO接受應屆生嗎?
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
臨床試驗是確保醫療器械和藥品使用時的安全性和有效性證明,《醫療器械臨床試驗質量管理規范》自2016年06月01日正式實施。本規范的實施執行和監督管理過程中存在著諸多不明朗的因素。在此形勢下,如何快速有效的進行臨床機構的篩選呢?下面思途聊聊怎么篩選合適的醫療器械臨床試驗機構?

雖然《醫療器械臨床試驗質量管理規范》中要求醫療器械臨床試驗需在經資質認定的醫療器械臨床試驗機構中,但截至目前,醫療器械臨床試驗機構目錄暫未公布。在食藥監辦械管〔2016〕41號文件關于貫徹實施《醫療器械臨床試驗質量管理規范》的通知中,要求申辦者在醫療器械臨床試驗機構資質認定相關規定出臺前,仍然選擇經資質認定的藥物臨床試驗機構開展臨床試驗。而醫療器械臨床試驗科室的選擇,從以往經驗看,醫療器械臨床試驗科室可以不受藥物臨床試驗機構認定專業科室范圍的限制。
藥物臨床試驗機構目錄是實時動態更新的,在選擇醫院時除了要了解機構資質是否符合要求。還需密切關注國家局和省級局的相關規定,隨時了解相關法規的更新。
在篩選主要研究者(PI)時,應從臨床基地科室名錄中篩選合適的主任醫生作為主要研究者,一般為科室主任(或主任級以上醫生);
主要研究者應是熟悉臨床藥理的臨床專家,有醫療器械臨床試驗的經驗,并具有一定的權威和專業影響力,可協調和組織其他單位共同實施臨床試驗。
主要研究者的選擇通常可以通過以下幾方面因素參考:
(1)曾與申辦者、CRO公司合作過研究項目的研究者;
(2)來自藥監管理部門的建議;
(3)參考臨床研究單位的名單;
(4)參考學術會議摘要;
(5)參考專家庫;
(6)要有充足的時間保證試驗的實施,對試驗研究工作感興趣;
同時還應確認PI是否有正在進行相關項目的研究,這可能影響研究者的時間精力,可能導致在開展過程混淆項目資料以及可能影響病例的入組速度。
申辦者在與臨床基地遴選調研的過程中, 除了基本的電話溝通后,還依據實際,預約研研究者,確定好見面時間。并攜帶樣品、詳細的產品技術資料(如:研究者手冊(使用說明書)、方案初稿及其它臨床前的研究資料)上門拜訪。經與研究者初步交談后,應定期跟進研究者的確認情況;
對于臨床試驗經費預算上,申辦者應盡量選擇能夠承受的費用的臨床基地,至于具體費用多少才合適,沒有絕對的標準,由申辦方自己來評估。
按照最新的《醫療器械臨床試驗質量管理規范》的規定,并結合具體的項目,在開展臨床試驗時,首先應考慮是否需要開展多中心臨床試驗;同時還應考慮臨床科室的試驗條件能否滿足要求,例如:是否具備充足的人員,是否配備試驗所需專業的設施和條件等因素都應加以充分考慮。
在臨床試驗管理過程中,除NMPA有基本的臨床試驗法規外,各省藥監部門及部分醫院在此基礎上還會有一些自己的規定,對此需要充分了解所選醫院的臨床試驗管理流程及操作要求之后,在實際操作過程中才會事半功倍。
盡可能就近篩選臨床機構,這關系到:(1)溝通和人力差旅費成本;(2)監查的便利性;(3)病例收集的難易程度、試驗費用等。
最后還要考慮科室的配合度,這一點十分重要。如果是通過院領導或臨床試驗機構主管部門讓科室接下這項目,有必要再去問問具體開展科室的主任。因為試驗的執行部門是科室,如果科室意愿不大,很可能導致項目延遲。因此與具體開展科室取得良好溝通配合,至關重要!
1、進入醫療器械臨床試驗機構備案管理信息系統—醫療器械—輸入備案號、機構名稱、省份、主研等信息點擊查詢。在查詢時應特別注意機構資質的有效期。
2、研究者的學術地位,可以登錄醫院官網查詢PI主要研究領域及方向。最好可以直接聯系相關科室主任詢問合作意向,相關操作經驗,病例入組速度,以及費用情況等。
3、臨床機構辦公室的聯系信息等,可以登錄醫院官網查詢醫院的機構辦聯系方式。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

大多數剛畢業的同學在準備進入臨研圈的時候,一定會被鋪天蓋地的行業專有名詞搞得暈頭轉向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請問貴司CEO接受應屆生嗎?

盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技

前面文章介紹過復腫的SSU立項流程,立項通過以后就可以進行下面三步了,分別是:倫理審查申請,遺傳辦申請(如需),合同審查申請。在復腫的伊柯夫網站上,立項通過后,這三步

因為SSU階段,有好多細節機構的官網上不會告訴你,你也不可能遇到不懂的問題就去問你的研究護士,因為她們人均手上幾十個項目,很容易被問得沒有耐心,這也是我想把一點經驗記

剛接觸CRO行業的小伙伴,在學習文件法規資料的同時,常看到一些英文類專業名詞不知道是什么意思。下面,一起看看常見的臨床試驗專業術語: CRO行業的常用術語解釋: 1:新藥研發

SSU是Study Start Up的縮寫,從最初的項目準備,到啟動訪視(Site Initiation Visit)之前所有的準備工作,對整個臨床研究項目的啟動非常關鍵。負責這個關鍵階段工作的部門人員,就叫做SS

何所謂溝通?溝者,構筑管道也;通者,順暢也。溝通是人與人之間以及人與群體之間思想與感情的傳遞和反饋的過程,以求思想達成一致和感情的通暢。溝通的目的是讓對方達成行動
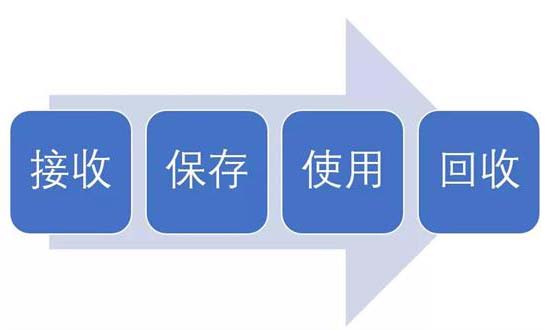
試驗用藥品是指用于臨床試驗的試驗藥物、對照藥品。試驗用藥品滲透到了臨床試驗過程中的每一個步驟,包括藥物的生產、包裝、運輸、保存、使用、回收等。今天我們從臨床試驗中

不少二三類需要臨床的產品,客戶一聽到臨床報價就退縮。既然這么貴,還不如自己做......事實真的是這樣嗎?臨床報價費用都由哪些組成?費用都誰收走了?自己做又有哪些風險?文

從事醫療器械注冊的小伙伴們可能都為同一個問題苦惱過,那就是醫療器械注冊單元的劃分。企業所設計開發出的產品,其所包含的產品范圍,是否可通過一個注冊單元完成注冊,從而
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
