淺談CRC生物樣本管理!生物樣本采集、處理、存儲(chǔ)、運(yùn)輸全過(guò)程注意事項(xiàng)
生物樣品分析在臨床試驗(yàn)中起著非常重要的作用,是臨床試驗(yàn)研究中一個(gè)關(guān)鍵的環(huán)節(jié),在臨床試驗(yàn)過(guò)程中,CRC很多時(shí)候也會(huì)被授權(quán)參與生物樣本的管理,因此我們小伙伴們也要掌握這項(xiàng)


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類(lèi)界定 · 申請(qǐng)創(chuàng)新
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2024-05-10 閱讀量:次
臨床研究是一項(xiàng)嚴(yán)謹(jǐn)?shù)墓ぷ鳎枰覀兙邆湄S富的專(zhuān)業(yè)知識(shí)和實(shí)踐經(jīng)驗(yàn)。作為臨研人,我們有責(zé)任和義務(wù)將我們所獲得的知識(shí)和經(jīng)驗(yàn)分享出去,幫助大家提高臨床研究的質(zhì)量和效率。本期內(nèi)容將帶來(lái)知情同意書(shū)簽署注意事項(xiàng),一起來(lái)看看吧。

(1)版本:務(wù)必確認(rèn)簽署倫理批準(zhǔn)的最新版木的知情同意書(shū)。
(2)類(lèi)型:確認(rèn)是否僅涉及一種類(lèi)型的知情,如涉及不同階段/類(lèi)型,需提前確認(rèn)本次雷簽署的類(lèi)型/階段。
(3)完整性:核對(duì)知情問(wèn)意書(shū)是否完整,頁(yè)數(shù)是否連貫,文字是否清晰可外,了解需簽署的內(nèi)容及部位,如不確定及時(shí)咨詢(xún)項(xiàng)目組,避免多簽/漏簽。
(4)剩余份數(shù):確認(rèn)中心可簽署的知情同意書(shū)份數(shù),如不足及時(shí)申請(qǐng)。
(5)授權(quán):確認(rèn)準(zhǔn)備簽署知情的研究者是否已經(jīng)獲得 PI 授權(quán),執(zhí)業(yè)地點(diǎn)是否為研光中心。
(6)隱私保護(hù):如同一天涉及多個(gè)受試者簽署知情,安排好各白知情時(shí)間,保護(hù)受試者隱私。
(1)簽署人員:所有篩選受試者都務(wù)必簽著知情同意書(shū),簽署知情同意書(shū)的受試者必須為授權(quán)知情同意簽署的本中心的研究者。
(2)版本:再次核對(duì)是否為倫理批準(zhǔn)的最新版本。
(3)簽署完整:確認(rèn)所有需填寫(xiě)部位均填寫(xiě),可能涉及中心號(hào)/篩選號(hào)/倫瑪聯(lián)系方式/研究者聯(lián)系方式/受試者簽署處 (一般) 兩處姓名簽寫(xiě))/研究者簽署處 (一般兩處姓名簽寫(xiě))/是否同意采集 PK 等所有需勾選處也要勾選完整,特殊受試者可能涉及監(jiān)護(hù)人/見(jiàn)證人簽署處。
(4)時(shí)間邏輯:知情同意書(shū)的簽署時(shí)間務(wù)必早于對(duì)受試者進(jìn)行臨床試驗(yàn)相關(guān)的操作。
(5)特殊受試者:如受試者為無(wú)民事行為能力/限制民事行為能;力/≥8 歲兒童/<8 歲兒童,需要監(jiān)護(hù)人簽署 (注明關(guān)系) 如為文盲/無(wú)閱讀能力者,需公證見(jiàn)證人簽署:公正見(jiàn)證人不應(yīng)為醫(yī)院的員工或受試者家屬,需見(jiàn)證人簽署時(shí)務(wù)必核對(duì)收集好身份信息:注意具體簽署情況應(yīng)與病歷中記錄情況一致。避免病歷記錄患者為文盲,但知情為患者本人簽署;
(6)充分考慮:從向受試者介紹知情內(nèi)容,到受試者簽署知情同意書(shū),應(yīng)保證受試者有充足的考慮時(shí)間。
(7)中心留存一份:簽署完整的同一版本知情同意書(shū)應(yīng)有兩份,其中一一份留存中心,另一份歸還給受試者保存,簽署當(dāng)天務(wù)必給到受試者并明確記錄在病歷中。
(8)病歷記錄:病歷當(dāng)中需詳細(xì)記錄知情人員及時(shí)間。
(9)其他:簽署時(shí)受試者和研究者盡可能使用相同深淺的黑色筆簽署,避免時(shí)間邏輯問(wèn)題。
(1)再次核對(duì):再次翻閱簽署完成的知情同意書(shū),確認(rèn)是否為最新版本,受試者篩選號(hào)、倫理聯(lián)系方式、研究者聯(lián)系方式是否填寫(xiě),涉及生物樣本采集同意的地方是否勾選或填寫(xiě)。
(2)知情更新:如果項(xiàng)目進(jìn)行過(guò)程中涉及知情更新,應(yīng)按照項(xiàng)目要求完成更新知情的簽署。
(3)隱私保護(hù):簽署完成的留存在研究中心的知情同意書(shū)不可帶離研究中心。
(4)撤回同意:如果受試者在項(xiàng)目進(jìn)行過(guò)程中不同意繼續(xù)參加項(xiàng)目,要求撤回知情同意,也不可以將發(fā)放給受試者的知情同意書(shū)要回。

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專(zhuān)注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類(lèi)界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

生物樣品分析在臨床試驗(yàn)中起著非常重要的作用,是臨床試驗(yàn)研究中一個(gè)關(guān)鍵的環(huán)節(jié),在臨床試驗(yàn)過(guò)程中,CRC很多時(shí)候也會(huì)被授權(quán)參與生物樣本的管理,因此我們小伙伴們也要掌握這項(xiàng)

關(guān)中心訪(fǎng)視(Close Out Visits,簡(jiǎn)稱(chēng)COV),想必大家都聽(tīng)說(shuō)過(guò)。作為臨床試驗(yàn)最后一個(gè)階段,COV也是非常重要的一個(gè)環(huán)節(jié),今天和大家分享一下作為監(jiān)查員在COV時(shí)應(yīng)該做哪些工作。什么時(shí)候

監(jiān)查員行業(yè)人員流動(dòng)性大,這就讓我們需要經(jīng)常面對(duì)項(xiàng)目的交接工作,如何讓工作交接不出問(wèn)題,接任CRA后面少填坑,讓后續(xù)工作得以順利推進(jìn),給大家提供以下五個(gè)要點(diǎn)

大家在項(xiàng)目中,是否遇到過(guò)ICF更新的情況?在ICF更新后,已由受試者簽署的知情同意書(shū),是否需要重新簽署呢?又有哪些情形不需要重新簽署呢?本期我們繼續(xù)跟大家分享知情同意書(shū)實(shí)

知情同意對(duì)從事臨床的CRC來(lái)說(shuō),并不陌生。日常工作中每時(shí)每刻都在與臨床試驗(yàn)受試者溝通交流,那么你知道知情同意書(shū)簽署注意事項(xiàng)及核查要點(diǎn)嗎?我們先來(lái)區(qū)分知情同意和知情同意

兒童受試者屬于弱勢(shì)群體(vulnerable subjects),參加臨床試驗(yàn)時(shí),應(yīng)給予更多的保護(hù)和尊重。前兩天分析了臨床項(xiàng)目管理中的進(jìn)度管理,今天和大家深度討論兒童受試者知情同意的年齡問(wèn)

在過(guò)去幾年的工作中,我發(fā)現(xiàn)SAE上報(bào)既是臨床試驗(yàn)工作中的重點(diǎn)難點(diǎn),也是CRC工作中的痛點(diǎn)。當(dāng)你是小白時(shí),看到SAE就很頭大,天然地產(chǎn)生一種畏懼心理,談SAE色變,當(dāng)你經(jīng)驗(yàn)比較豐富
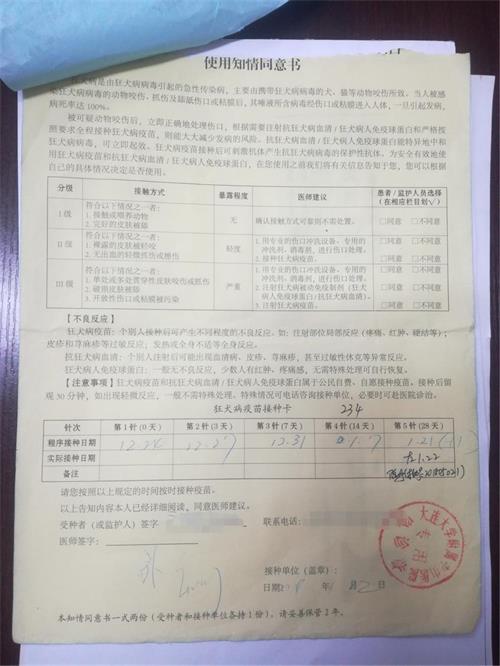
什么是知情同意和知情同意書(shū)? 一個(gè)受試者在被告知與其做出決定有關(guān)的所有試驗(yàn)信息后,自愿確認(rèn)他或她參加一個(gè)特定試驗(yàn)的意愿過(guò)程。知情同意由書(shū)面的、簽字并注明日期的知情同

全球范圍內(nèi)醫(yī)療器械臨床試驗(yàn)遠(yuǎn)程監(jiān)查的模式正在逐漸展開(kāi)。但是,遠(yuǎn)程監(jiān)查的開(kāi)展必須有兩個(gè)前提條件:一是有適合遠(yuǎn)程管理的新工具;二是各個(gè)臨床研究點(diǎn)有成熟的臨床研究管理經(jīng)驗(yàn)。同時(shí)
兒童并不是體積縮小版的成年人,他們有著與成年人不同的生理特征和心理特點(diǎn),也有著相對(duì)特殊的家庭地位。以?xún)和癁槭褂脤?duì)象的醫(yī)藥研發(fā)必不可少,在臨床試驗(yàn)實(shí)施時(shí),兒童屬于弱
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專(zhuān)屬《落地解決方案》及報(bào)價(jià)
咨詢(xún)相關(guān)問(wèn)題或咨詢(xún)報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
