中美博弈關系微妙會影響FDA(510K)評審的公平性嗎?
自美國總統更替以來,中美雙方交替制裁,接觸FDA 510K申請的朋友也許留意到,近一兩年FDA在評審510K文件時,提出的問題越來越尖銳。聯系到近兩年的中美關系變化,例如美國打壓華為、前兩天
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
來源:基因talks
*注:本內容僅作方向參考,具體以官方政策為準!
2021年3月18日,國家藥品監督管理局(NMPA)發布最新《醫療器械監督管理條例》(國務院令第739號),并自2021年6月1日起施行,對腫瘤NGS基因檢測有何影響?
醫療器械,是指直接或者間接用于人體的儀器、設備、器具、體外診斷試劑及校準物、材料以及其他類似或者相關的物品,包括所需要的計算機軟件(基本是二類)。所以腫瘤NGS基因檢測試劑盒是一種分子遺傳檢測類體外診斷產品(IVDs)歸屬于三類醫療器械,其監管由國家藥品監督管理局(NMPA)負責,管理法規是以國務院令形式發布的《醫療器械監督管理條例》。
回到腫瘤NGS基因檢測,是不是說嚴格按照IVDs進行監管呢?不是的,這與國情也有關系,這些年,中國腫瘤NGS基因檢測產業處在市場興起的初中級階段,監管制度還十分不完善(此前我國對LDTs項目尚沒有明確的政策、法規與監管措施,可以認為是監管灰度區),所以大家都在打著LDTs(實驗室自建檢測)的口號開展臨床腫瘤NGS基因檢測服務。當然,腫瘤NGS基因檢測以LDTs的形式得以應用是有利于推進我國個體化醫學和精準醫學的臨床應用和發展。但是,帶來的一個問題就是:亂!魚龍混雜!良莠不齊!以及無序的競爭!
那么,LDTs開展是否會建立行業標準和規范,實施監管呢?(此前已有城市開始試行LDTs,比如廣東省和江蘇省,但均不是國家層面)是否會創造公平有序的競爭環境呢?這是大家這幾年一直在討論的話題:合規化!
2018年,有人發出:“腫瘤NGS基因檢測行業三年內必將洗牌”的呼聲,如今三年期限已到,腫瘤NGS基因檢測行業離洗牌還有多遠?
IVDs(InVitro Diagnostic devices),即體外診斷產品,是指在人體之外,通過對人體樣本(血液、體液、組織等)進行檢測而獲取臨床信息,進而為用于疾病診斷或包括為治療或預防疾病確定患者健康狀態的其它目的的試劑、儀器和系統,并作為商品銷售。
在國內,IVDs的監管是由NMPA負責,管理法規是以國務院令形式發布的《醫療器械監督管理條例》。同樣,IVDs按低、中和高風險分為三類:
第一類:實行產品備案管理;
第二、三類:實行產品注冊管理,二類由省級藥監部門負責注冊,三類由NMPA負責注冊;
腫瘤NGS基因檢測試劑盒(分子遺傳檢測)屬于三類(醫療器械)!NMPA負責注冊!
所以,注重合規的腫瘤NGS基因檢測公司都在積極布局IVDs注冊(三類)。可是即便如此,截止到目前,國內也僅有10款腫瘤NGS-IVDs產品獲批,且均為基于組織或血細胞的NGS小panel(2-10基因),針對的癌種單一,如肺癌,結直腸癌或卵巢癌,無法滿足偌大的市場或臨床需求,因為當前腫瘤NGS-IVDs產品面臨的一個現狀就是“獲批即落后”。
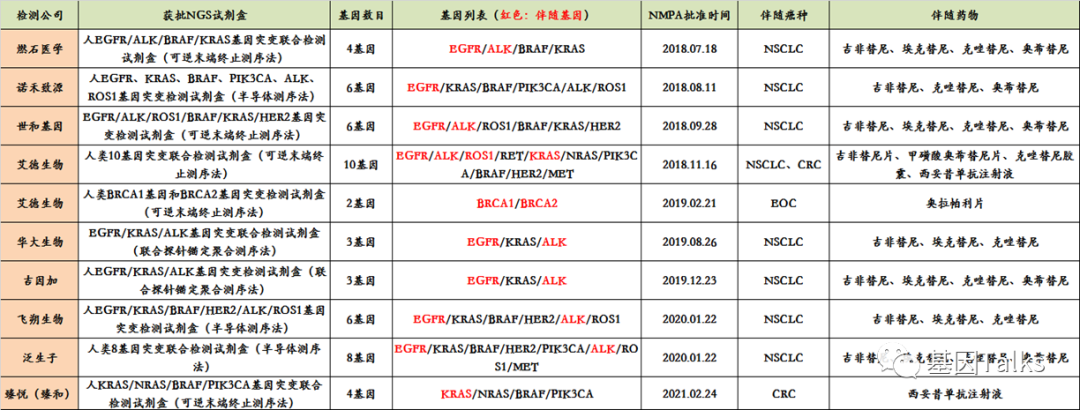
此外,如果腫瘤NGS基因檢測公司修改了NMPA注冊或批準的試劑或檢測系統(比如改變了試劑組成,改變了臨床預期用途(比如將“輔助診斷”改為“早篩”,NGS基因panel擴大等),數據庫的升級等),那么它就不是IVDs產品了。
所以,NMPA批準的這些腫瘤NGS-IVDs試劑盒還是當初的那個“少年”嘛?(大家自行判斷)如果不是,它變成了什么?沒錯,就是LDTs!
LDTs(Laboratory Developed Tests),即實驗室自建檢測,是指醫學檢驗部門自行研發、驗證和使用的檢測方法,僅在醫學檢驗部門內部使用,不作為商品出售給其它醫學檢驗部門、醫院及個人。
在美國,LDTs是指在CLIA認證的實驗室內研發的用于患者疾病診療的檢測方法和試劑,僅限于研發該LDTs的實驗室使用。在CLIA規則下定期進行檢查,確保LDTs遵循必要的程序,并且LDTs檢測只能是在執業醫生、實驗室科學家、遺傳學家和分子病理學家等實驗室專家的指導下進行。

美國對LDTs有著較為明確的監管措施,并且與醫保制度相關,而我國對LDTs項目尚沒有明確的政策、法規與監管措施。國內針對LDTs在2000年發布的《醫療器械監督管理條例》(國務院令第276號)中的第十條規定:醫療機構根據本單位的臨床需要,可以研制醫療器械,在執業醫師指導下在本單位使用。隨后,2014年新發布的《醫療器械監督管理條例》(國務院令第650號)刪除了這一條,但并沒有規定不允許自制醫療器械(腫瘤NGS基因檢測監管的灰度區)。

腫瘤NGS基因檢測以LDTs的形式得以應用有利于推進我國個體化醫學和精準醫學的臨床應用和發展,但是經過幾年的發展,大家可以發現市場一片亂象,都在打著LDTs的口號開展臨床腫瘤NGS基因檢測服務。故此,我國LDTs或將迎來新一輪監管。
2021年3月18日,國家藥品監督管理局(NMPA)發布最新《醫療器械監督管理條例》(國務院令第739號),并自2021年6月1日起施行。其中,第五十三條規定:對國內尚無同品種產品上市的體外診斷試劑,符合條件的醫療機構根據本單位的臨床需要,可自行研制,在執業醫師指導下在本單位內使用。具體管理辦法由國務院藥品監督管理部門會同國務院衛生主管部門制定。

最新的《醫療器械監督管理條例》(國務院令第739號)新增了LDTs的規定,在LDTs合規的同時亦會帶來監管,勢必會帶來新一輪的“洗牌”,具體的LDTs管理細則大家還是期待下吧(比如,無同品種產品怎么界定?怎么樣算同品種產品?產品臨床需要的標準是什么?符合條件的醫療機構是如何認定的?自行研制對實驗室規格,對人員,還有性能(確認)等要求是什么?執業醫師是本機構還是外部人員?本單位內使用?等等),我們不作過多的揣測(皮包公司肯定是難了,因為涉及到OEM報告蓋章及責任人的問題;LDTs開始前期可能會有一個過渡期,但是細則大概率是出來了),具體管理辦法將由國務院藥品監督管理部門會同國務院衛生主管部門制定。
我們都知道,腫瘤NGS基因檢測是日新月異的檢測產品,比如基因檢測panel的臨床應用(從單基因到多基因的趨勢),臨床診療指南的不斷更新,生物標志物的不斷涌現(如TMB,HRD,MRD等),檢測技術的不斷出現等,都決定了腫瘤NGS基因檢測更適用LDTs的管理辦法,這時候LDTs的政策、法規與監管措施就顯得尤為重要(可能是通過認可實驗室能力的途徑來管理)。

LDTs國家層面的規范化監管,勢必將帶來兩極分化,幾家歡喜,幾家愁。即實驗室配置齊全,檢測方法學成熟,SOP質量管理體系完整,具備生信分析能力的實力企業將進一步擴大自己的優勢,繼續領跑,反觀一些“小作坊”公司,可能將在LDTs的規范化監管過程中逐漸掉隊甚至是被淘汰。
腫瘤NGS基因檢測公司普遍盈利不佳,虧損亦是常態,如果規范化監管來臨(以及不確定的新冠肺炎疫情),該怎么辦?我想先考慮活下去撐到最后才是關鍵。市場沒有眼淚,強者恒強,而弱者只有忍辱負重,蟄伏前行,當然也不排除“彎道超車”的可能。
從目前發展局勢來看,腫瘤NGS基因檢測行業不可能再是百花齊放的景象,但也不可能是一枝獨秀的景象,而是兩枝,三枝,甚至更多...祝大家越來越好!
最后,再給大家帶來一個好消息和一個壞消息,好消息就是本次《醫療器械監督管理條例》(國務院令第739號)鼓勵行業創新發展,將醫療器械創新納入發展重點,對創新醫療器械予以優先審評審批;并且在融資、信貸等方面予以支持,利好!

壞消息就是本次《醫療器械監督管理條例》(國務院令第739號)加大了懲處力度,提高了違法成本,一不小心就可能終身禁業,錢財兩空!

參考資料:
1.https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20210318084145148.html

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

自美國總統更替以來,中美雙方交替制裁,接觸FDA 510K申請的朋友也許留意到,近一兩年FDA在評審510K文件時,提出的問題越來越尖銳。聯系到近兩年的中美關系變化,例如美國打壓華為、前兩天

2021年2月9日,國務院總理李克強簽署第739號國務院令,公布修訂后的《醫療器械監督管理條例》(以下簡稱《條例》)。《條例》自2021年6月1日起施行。日前,司法部、市場監管總局、

2023年7月發布的《醫療器械分類目錄動態調整工作程序》明確將灸療設備納入Ⅱ類醫療器械管理,艾灸儀首次被單獨劃入分類目錄的“物理治療設備”子類中。這一調整源于國
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
