臨床新藥試驗四期內容及方案設計要點
我國《藥品注冊管理辦法》規定臨床試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ臨床試驗在藥品上市前進行,而Ⅳ期臨床試驗是新藥臨床試驗的一個重要組成部分,是對新藥上市前Ⅰ
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
思途9月11日訊
第一條 根據黨的十九屆三中全會審議通過的《中共中央關于深化黨和國家機構改革的決定》、《深化黨和國家機構改革方案》和第十三屆全國人民代表大會第一次會議批準的《國務院機構改革方案》,制定本規定。
第二條 國家藥品監督管理局是國家市場監督管理總局管理的國家局,為副部級。
第三條 國家藥品監督管理局貫徹落實黨中央關于藥品監督管理工作的方針政策和決策部署,在履行職責過程中堅持和加強黨對藥品監督管理工作的集中統一領導。主要職責是:
(一)負責藥品(含中藥、民族藥,下同)、醫療器械和化妝品安全監督管理。擬訂監督管理政策規劃,組織起草法律法規草案,擬訂部門規章,并監督實施。研究擬訂鼓勵藥品、醫療器械和化妝品新技術新產品的管理與服務政策。
(二)負責藥品、醫療器械和化妝品標準管理。組織制定、公布國家藥典等藥品、醫療器械標準,組織擬訂化妝品標準,組織制定分類管理制度,并監督實施。參與制定國家基本藥物目錄,配合實施國家基本藥物制度。
(三)負責藥品、醫療器械和化妝品注冊管理。制定注冊管理制度,嚴格上市審評審批,完善審評審批服務便利化措施,并組織實施。
(四)負責藥品、醫療器械和化妝品質量管理。制定研制質量管理規范并監督實施。制定生產質量管理規范并依職責監督實施。制定經營、使用質量管理規范并指導實施。
(五)負責藥品、醫療器械和化妝品上市后風險管理。組織開展藥品不良反應、醫療器械不良事件和化妝品不良反應的監測、評價和處置工作。依法承擔藥品、醫療器械和化妝品安全應急管理工作。
(六)負責執業藥師資格準入管理。制定執業藥師資格準入制度,指導監督執業藥師注冊工作。
(七)負責組織指導藥品、醫療器械和化妝品監督檢查。制定檢查制度,依法查處藥品、醫療器械和化妝品注冊環節的違法行為,依職責組織指導查處生產環節的違法行為。
(八)負責藥品、醫療器械和化妝品監督管理領域對外交流與合作,參與相關國際監管規則和標準的制定。
(九)負責指導省、自治區、直轄市藥品監督管理部門工作。
(十)完成黨中央、國務院交辦的其他任務。
(十一)職能轉變。
1.深入推進簡政放權。減少具體行政審批事項,逐步將藥品和醫療器械廣告、藥物臨床試驗機構、進口非特殊用途化妝品等審批事項取消或者改為備案。對化妝品新原料實行分類管理,高風險的實行許可管理,低風險的實行備案管理。
2.強化事中事后監管。完善藥品、醫療器械全生命周期管理制度,強化全過程質量安全風險管理,創新監管方式,加強信用監管,全面落實“雙隨機、一公開”和“互聯網+監管”,提高監管效能,滿足新時代公眾用藥用械需求。
3.有效提升服務水平。加快創新藥品、醫療器械審評審批,建立上市許可持有人制度,推進電子化審評審批,優化流程、提高效率,營造激勵創新、保護合法權益環境。及時發布藥品注冊申請信息,引導申請人有序研發和申報。
4.全面落實監管責任。按照“最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責”要求,完善藥品、醫療器械和化妝品審評、檢查、檢驗、監測等體系,提升監管隊伍職業化水平。加快仿制藥質量和療效一致性評價,推進追溯體系建設,落實企業主體責任,防范系統性、區域性風險,保障藥品、醫療器械安全有效。
(十二)有關職責分工。
1.與國家市場監督管理總局的有關職責分工。國家藥品監督管理局負責制定藥品、醫療器械和化妝品監管制度,并負責藥品、醫療器械和化妝品研制環節的許可、檢查和處罰。省級藥品監督管理部門負責藥品、醫療器械和化妝品生產環節的許可、檢查和處罰,以及藥品批發許可、零售連鎖總部許可、互聯網銷售第三方平臺備案及檢查和處罰。市縣兩級市場監管部門負責藥品零售、醫療器械經營的許可、檢查和處罰,以及化妝品經營和藥品、醫療器械使用環節質量的檢查和處罰。
2.與國家衛生健康委員會的有關職責分工。國家藥品監督管理局會同國家衛生健康委員會組織國家藥典委員會并制定國家藥典,建立重大藥品不良反應和醫療器械不良事件相互通報機制和聯合處置機制。
3.與商務部的有關職責分工。商務部負責擬訂藥品流通發展規劃和政策,國家藥品監督管理局在藥品監督管理工作中,配合執行藥品流通發展規劃和政策。商務部發放藥品類易制毒化學品進口許可前,應當征得國家藥品監督管理局同意。
4.與公安部的有關職責分工。公安部負責組織指導藥品、醫療器械和化妝品犯罪案件偵查工作。國家藥品監督管理局與公安部建立行政執法和刑事司法工作銜接機制。藥品監督管理部門發現違法行為涉嫌犯罪的,按照有關規定及時移送公安機關,公安機關應當迅速進行審查,并依法作出立案或者不予立案的決定。公安機關依法提請藥品監督管理部門作出檢驗、鑒定、認定等協助的,藥品監督管理部門應當予以協助。

第四條 國家藥品監督管理局設下列內設機構(副司局級):
(一)綜合和規劃財務司。負責機關日常運轉,承擔信息、安全、保密、信訪、政務公開、信息化、新聞宣傳等工作。擬訂并組織實施發展規劃和專項建設規劃,推動監督管理體系建設。承擔機關和直屬單位預決算、財務、國有資產管理及內部審計工作。組織起草綜合性文稿和重要會議文件。
(二)政策法規司。研究藥品、醫療器械和化妝品監督管理重大政策。組織起草法律法規及部門規章草案,承擔規范性文件的合法性審查工作。承擔執法監督、行政復議、行政應訴工作。承擔行政執法與刑事司法銜接管理工作。承擔普法宣傳工作。
(三)藥品注冊管理司(中藥民族藥監督管理司)。組織擬訂并監督實施國家藥典等藥品標準、技術指導原則,擬訂并實施藥品注冊管理制度。監督實施藥物非臨床研究和臨床試驗質量管理規范、中藥飲片炮制規范,實施中藥品種保護制度。承擔組織實施分類管理制度、檢查研制現場、查處相關違法行為工作。參與制定國家基本藥物目錄,配合實施國家基本藥物制度。
(四)藥品監督管理司。組織擬訂并依職責監督實施藥品生產質量管理規范,組織擬訂并指導實施經營、使用質量管理規范。承擔組織指導生產現場檢查、組織查處重大違法行為工作。組織質量抽查檢驗,定期發布質量公告。組織開展不良反應監測并依法處置。承擔放射性藥品、麻醉藥品、毒性藥品及精神藥品、藥品類易制毒化學品監督管理工作。
(五)醫療器械注冊管理司。組織擬訂并監督實施醫療器械標準、分類規則、命名規則和編碼規則,擬訂并實施醫療器械注冊管理制度。擬訂并監督實施醫療器械臨床試驗質量管理規范、技術指導原則。承擔組織檢查研制現場、查處違法行為工作。
(六)醫療器械監督管理司。組織擬訂并依職責監督實施醫療器械生產質量管理規范,組織擬訂并指導實施經營、使用質量管理規范。承擔組織指導生產現場檢查、組織查處重大違法行為工作。組織質量抽查檢驗,定期發布質量公告。組織開展不良事件監測并依法處置。
(七)化妝品監督管理司。組織實施化妝品注冊備案工作。組織擬訂并監督實施化妝品標準、分類規則、技術指導原則。承擔擬訂化妝品檢查制度、檢查研制現場、依職責組織指導生產現場檢查、查處重大違法行為工作。組織質量抽查檢驗,定期發布質量公告。組織開展不良反應監測并依法處置。
(八)科技和國際合作司(港澳臺辦公室)。組織研究實施藥品、醫療器械和化妝品審評、檢查、檢驗的科學工具和方法,研究擬訂鼓勵新技術新產品的管理與服務政策。擬訂并監督實施實驗室建設標準和管理規范、檢驗檢測機構資質認定條件和檢驗規范。組織實施重大科技項目。組織開展國際交流與合作,以及與港澳臺地區的交流與合作。協調參與國際監管規則和標準的制定。
(九)人事司。承擔機關和直屬單位的干部人事、機構編制、勞動工資和教育工作,指導相關人才隊伍建設工作。承擔執業藥師資格管理工作。
機關黨委。負責機關和在京直屬單位的黨群工作。
離退休干部局。負責機關離退休干部工作,指導直屬單位離退休干部工作。

第五條 國家藥品監督管理局機關行政編制216名(含兩委人員編制2名、援派機動編制2名、離退休干部工作人員編制20名)。設局長1名,副局長4名,藥品安全總監1名,藥品稽查專員6名,正副司長職數32名(含機關黨委專職副書記1名),離退休干部局領導職數2名。
第六條 國家藥品監督管理局所屬事業單位的設置、職責和編制事項另行規定。
第七條 本規定由中央機構編制委員會辦公室負責解釋,其調整由中央機構編制委員會辦公室按規定程序辦理。
第八條 本規定自2018年7月29日起施行。
第七條 本規定由中央機構編制委員會辦公室負責解釋,其調整由中央機構編制委員會辦公室按規定程序辦理。
第八條 本規定自2018年7月29日起施行。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

我國《藥品注冊管理辦法》規定臨床試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ臨床試驗在藥品上市前進行,而Ⅳ期臨床試驗是新藥臨床試驗的一個重要組成部分,是對新藥上市前Ⅰ

方案偏離和方案違背是我們在平時工作過程中,非常容易遇到的一種情況,今天,我們就來聊一下應該 如何做才能更好的降低方案偏離/違背發生呢? 1.定義 其實GCP中并未對方案偏離

PD和PV,對于工作久的CRA來說,是個比較困惑的問題,因為對于方案違背和方案偏離的定義,每個公司SOP或不同項目的要求不一樣。有些公司只有PD,有些公司PD和PV分得很清楚,經歷了幾

在臨床試驗方案的設計過程中,大家都會盡可能的考慮到各種可能影響試驗的因素,并制定標準操作規程,盡量避免和減少在試驗中可能出現違背及偏離方案的情況發生,但在試驗的執
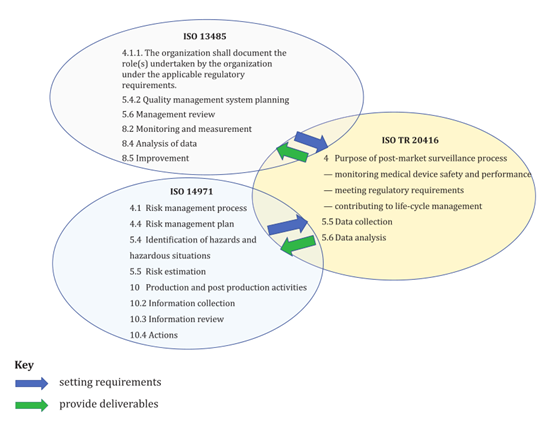
在2020年7月國際標準化組織(ISO)發布了ISO/TR 20416醫療器械 制造商的上市后監督對如何進行上市后監督提供了更詳細的指導。特別地,該標準也可以作為滿足ISO 13485和ISO 14971要求的方法

我們學習了什么是PD(方案偏離)和PV(方案違背),那么問題就來了:很多國內小公司和小藥企,臨床醫學團隊不是很完善(結構就是:醫療器械臨床試驗公司配備一個經理+幾個CRA),

醫療器械臨床試驗中違背方案的情況時有發生,難以避免。我們需要學習和借鑒國際多中心臨床試驗項目試驗設計嚴謹科學、操作流程標準化及數據處理真實等做法,以切實減少方案違

臨床試驗方案設計包括醫學設計、倫理設計、統計設計、試驗管理設計4個方面。倫理設計應遵循《赫爾辛基宣言》、國際醫學科學組織委員會《人體生物醫學研究國際倫理指南》和我國

醫療器械臨床試驗醫學撰寫,包括撰寫臨床試驗方案、病例報告表、研究病歷、病人日志、知情同意書、總結報告、分中心小結、中期報告、研究者手冊等。"

由于醫院本身工作流程、時間安排存在沖突等偶發性因素,出現臨床試驗方案違背情形,如何應對及處理呢,我們一下來看一下。
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
