體外診斷試劑IVD的貯存條件和運輸要求
在我國,體外診斷試劑(IVD)是指:可單獨使用或與儀器、器具、設備或系統組合使用, 在疾病的預防、診斷、治療監測、預后觀察、健康狀態評價以及遺傳性疾病的預測過程中, 用于對人體樣
來源:醫療器械注冊代辦 發布日期:2025-01-02 閱讀量:次
國家藥品監督管理局醫療器械技術審評中心于2024年12月10日公開《EB病毒IgM抗體檢測試劑盒(電化學發光法)》產品注冊技術審評報告。申請人:羅氏診斷公司 Roche Diagnostics GmbH。
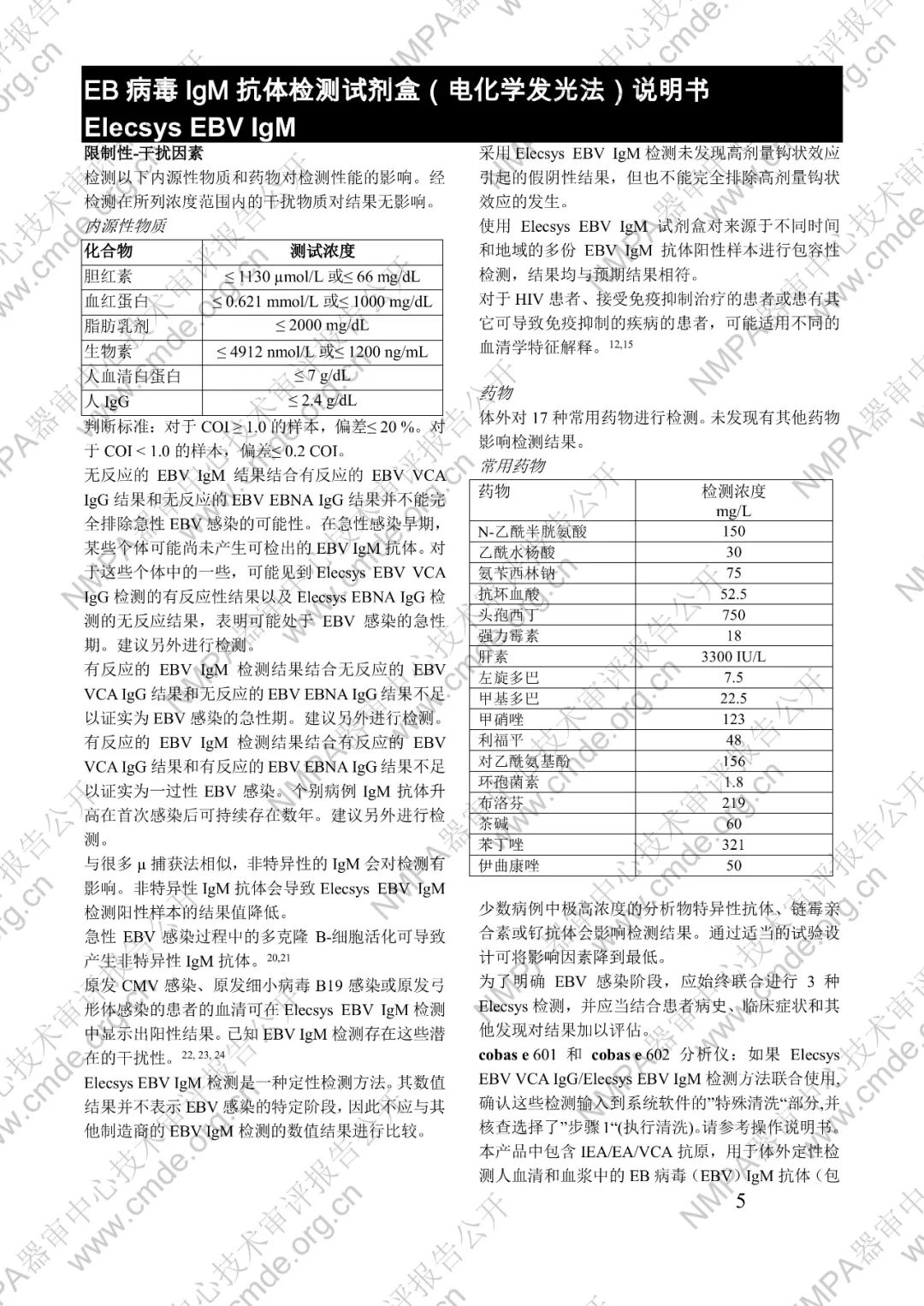
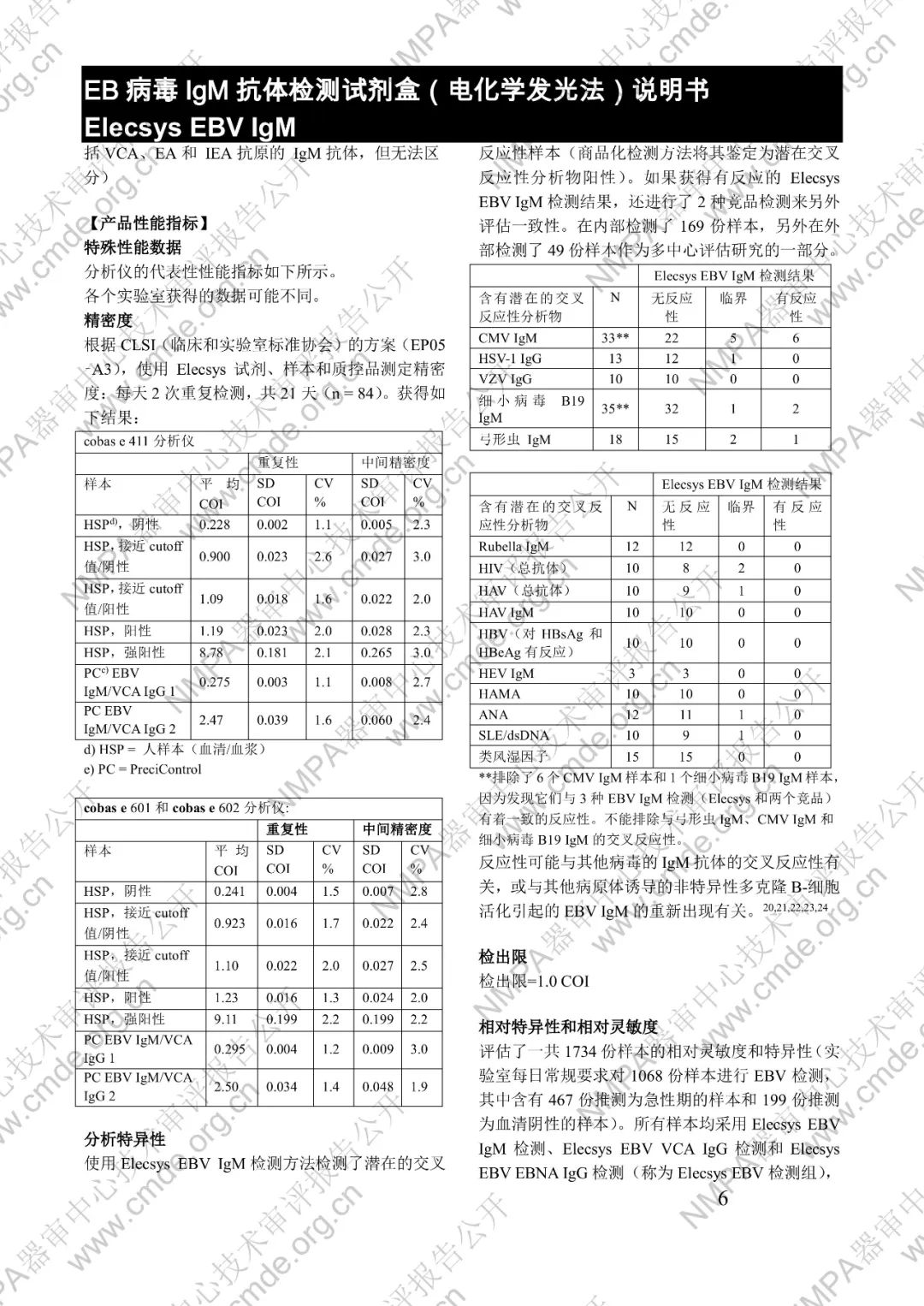
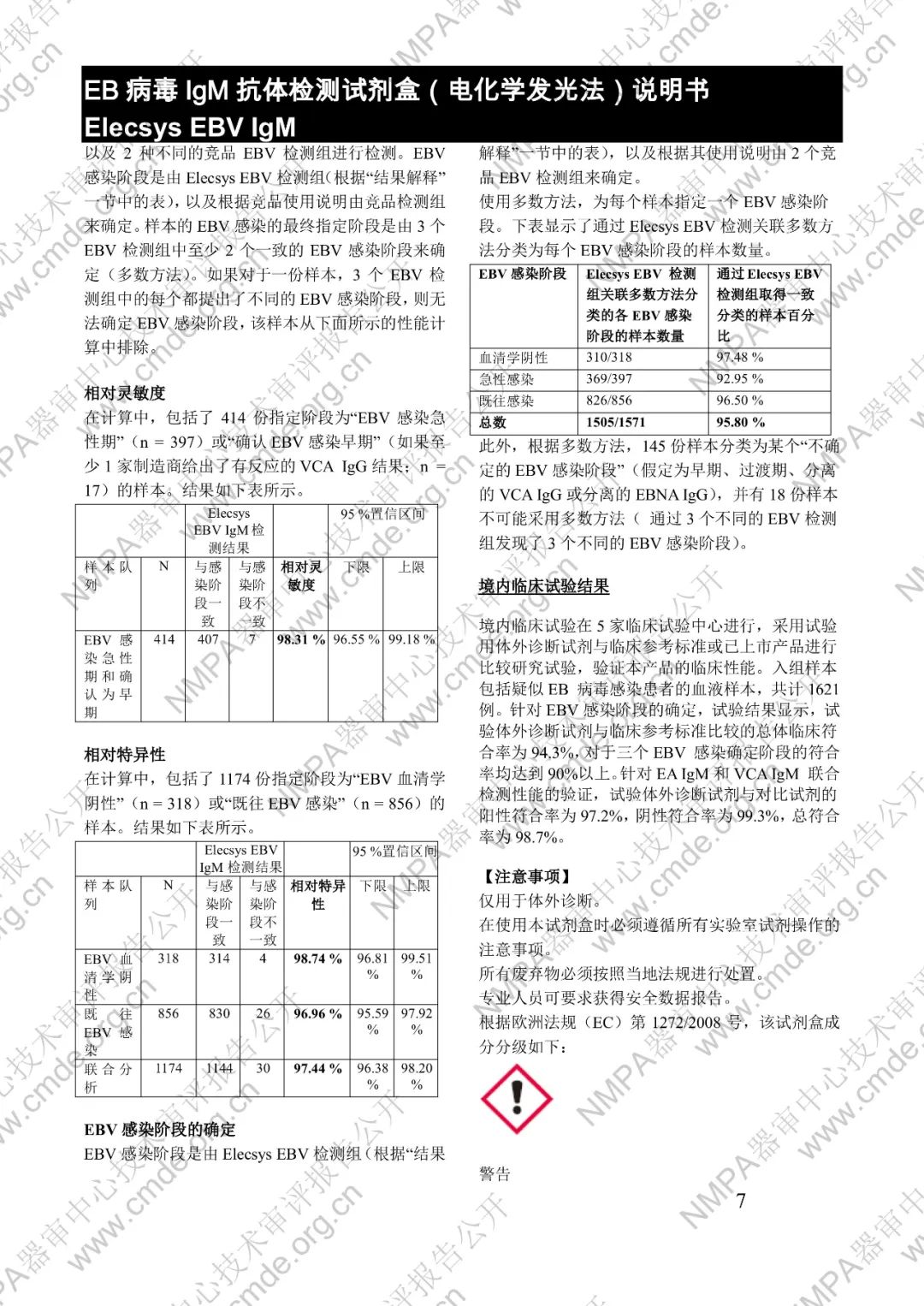
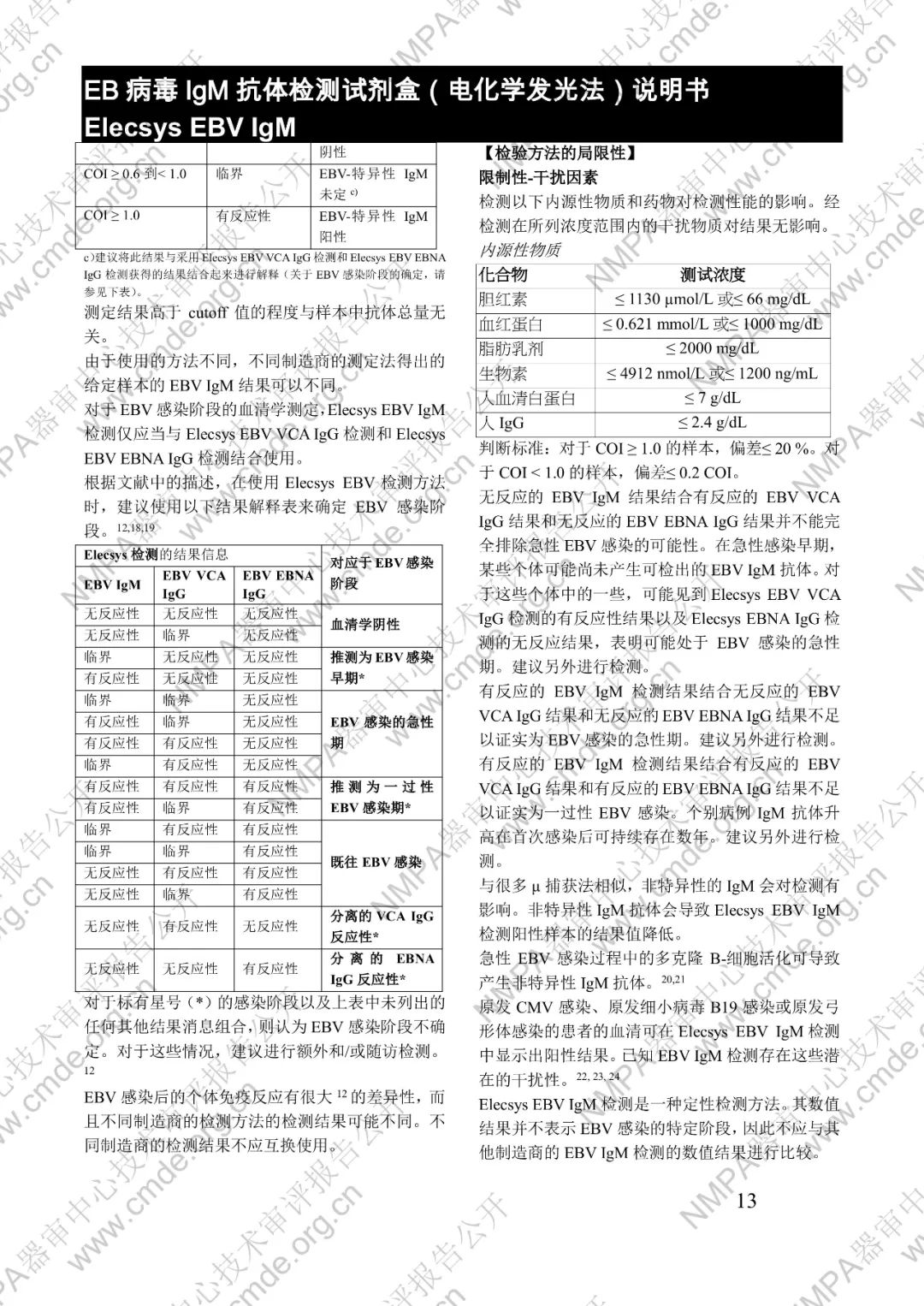
本產品用于體外定性檢測人血清和血漿中的 EB 病毒(EBV)IgM 抗體(包括 VCA、EA 和 IEA 抗原的 IgM 抗體,但無法區分)。本產品用于輔助診斷傳染性單核細胞增多癥和判定 EBV 感染階段。
μ-捕獲原理。總檢測時間:18 分鐘。第 1 次孵育:使用樣本稀釋液自動稀釋樣本。加入生物素化的 anti-h-IgM 特異性單克隆抗體片段。第 2 次孵育:加入釕復合物標記的 EBV 特異性重組抗原和包被鏈霉親合素的微粒。該復合物在生物素和鏈霉親合素的相互作用下結合到固相載體上。將反應液吸入測量池中,通過電磁作用將微粒吸附在電極表面。除去未與微粒結合物質。給電極加以一定的電壓,使復合物化學發光,并通過光電倍增器測量發光強度。儀器通過軟件(比較由樣本反應產物獲得的電化學發光信號值和先前定標獲得的 cutoff 值)自動計算檢測結果。

























來源:NMPA

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

在我國,體外診斷試劑(IVD)是指:可單獨使用或與儀器、器具、設備或系統組合使用, 在疾病的預防、診斷、治療監測、預后觀察、健康狀態評價以及遺傳性疾病的預測過程中, 用于對人體樣

2020年初,公眾號臨研人之家聯合藥研社開展了一項匿名的橫截面在線問卷調查。調查對象是中國境內的在職CRA和CRC(不含項目經理、人事主管等其他臨床試驗相關職位)。調查目的旨在

為進一步規范體外診斷試劑的管理,國家藥監局器審中心組織制定了《人類SDC2基因甲基化檢測試劑臨床試驗資料技術審評要點》、《異常凝血酶原測定試劑臨床試驗資料技術審評要點》

2016年起,醫療機構對有冷鏈要求的體外診斷試劑實施了入庫驗收制度,要求供應商按照醫院規定的時間將產品送到科室,必須由試劑管理部門驗收人員、科室人員雙方一起驗收,驗收要

為落實《醫療器械監督管理條例》(國務院令第739號)要求,根據《醫療器械注冊與備案管理辦法》(市場監管總局令第47號)《體外診斷試劑注冊與備案管理辦法》(市場監管總局令第48號),

分子檢測市場概覽 分子檢測是一種使用DNA及/或RNA檢測技術對組成細胞及體液進行研究以鑒定分子層面的特征及異常的實驗室研究方法。分子檢測廣泛用于各類行業。除實驗室應用外,

2020年8月,歐盟委員會發布了MDR和IVDR法規下對于UDI系統使用的常見問題解答,小編對其梳理和總結如下:"

體外診斷(In Vitro Diagnosis,下稱IVD),是在人體之外,通過對人體樣本(血液、體液、組織等)進行檢測而獲取臨床診斷信息,進而判斷疾病或機體功能的產品和服務。IVD已經成為人類

近日,湖南省藥品監督管理局發布公告,決定對第二、三類醫療器械生產許可行政審批事項實行全程無紙化網上辦理,即實現第二、三類醫療器械生產許可“網上申報、網上受理、網上

近日,湖南省藥品監督管理局發布公告,決定對第二、三類醫療器械生產許可行政審批事項實行全程無紙化網上辦理,即實現第二、三類醫療器械生產許可“網上申報、網上受理、網上
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
