臨床崗位科普|CRA/CTA/CRC/CRO/DM/PV/RA是什么意思?
大多數(shù)剛畢業(yè)的同學(xué)在準(zhǔn)備進(jìn)入臨研圈的時(shí)候,一定會(huì)被鋪天蓋地的行業(yè)專有名詞搞得暈頭轉(zhuǎn)向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請(qǐng)問貴司CEO接受應(yīng)屆生嗎?


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2023-10-10 閱讀量:次
?
今天我們來從CRC的角度詳細(xì)解讀一下新版GCP與老版GCP中的安全性事件報(bào)告。
CRC的職責(zé)里面有一條是協(xié)助研究者上報(bào)安全性報(bào)告,那么我們今天就安全性報(bào)告改版前后對(duì)CRC來說都有改變呢?

首先來看下2003版GCP研究者的職責(zé)中第二十六條:研究者有義務(wù)采取必要的措施以保障受試者的安全,并記錄在案。在臨床試驗(yàn)過程中如發(fā)生嚴(yán)重不良事件,研究者應(yīng)立即對(duì)受試者采取適當(dāng)?shù)闹委煷胧瑫r(shí)報(bào)告藥品監(jiān)督管理部門、衛(wèi)生行政部門、申辦者和倫理委員會(huì),并在報(bào)告上簽名及注明日期。
這里對(duì)安全性報(bào)告的上報(bào)僅僅只有110個(gè)字符,但是卻讓我們CRC手忙腳亂呢,因?yàn)橐獏f(xié)助研究者在研究者獲知SAE事件的24小時(shí)之內(nèi)上報(bào)多個(gè)部門,其中僅衛(wèi)生行政相關(guān)部門就要上報(bào)三處,分別是國家局、省局、和衛(wèi)健委,需要優(yōu)先傳真發(fā)送報(bào)告。如果傳真失敗的話,要保留傳真失敗的回執(zhí),并且是連續(xù)傳真失敗三次的回執(zhí)。收集這些傳真失敗的九份回執(zhí)之后,還要盡快補(bǔ)充郵件。因?yàn)閭髡媸×耍蔷椭荒茑]件再次發(fā)送,哦對(duì)了,比如鄭州這邊的省局是發(fā)送EMS上報(bào),還要及時(shí)預(yù)約快遞,24小時(shí)之內(nèi)協(xié)助研究者完成寄送。這些動(dòng)作做完之后才算是上報(bào)至國家局、省局及衛(wèi)健委。完成這些之后我們還要以最快的速度協(xié)助研究者上報(bào)至申辦方,再協(xié)助研究者按照本中心的要求上報(bào)本中心倫理及機(jī)構(gòu)。這樣一個(gè)完整的安全性報(bào)告才算協(xié)助研究者上報(bào)完成,后續(xù)要做的比較及時(shí)的就是在24小時(shí)之內(nèi)錄入至EDC(這個(gè)需要依照項(xiàng)目要求及時(shí)錄入)。到這里,我們CRC才算松了口氣,可見2003版GCP中關(guān)于研究者對(duì)安全性上報(bào),CRC的協(xié)助任務(wù)有多繁重。這也就是為什么即使一個(gè)很有經(jīng)驗(yàn)的CRC當(dāng)聽到要協(xié)助研究者上報(bào)安全性報(bào)告時(shí),也會(huì)稍有壓力的原因啦!
那么咱們?cè)僖黄饋砜聪?020版GCP中關(guān)于研究者的安全性報(bào)告:
第二十六條研究者的安全性報(bào)告應(yīng)當(dāng)符合以下要求:
除試驗(yàn)方案或者其他文件(如研究者手冊(cè))中規(guī)定不需立即報(bào)告的嚴(yán)重不良事件外,研究者應(yīng)當(dāng)立即向申辦者書面報(bào)告所有嚴(yán)重不良事件,隨后應(yīng)當(dāng)及時(shí)提供詳盡、書面的隨訪報(bào)告。嚴(yán)重不良事件報(bào)告和隨訪報(bào)告應(yīng)當(dāng)注明受試者在臨床試驗(yàn)中的鑒認(rèn)代碼,而不是受試者的真實(shí)姓名、公民身份號(hào)碼和住址等身份信息。試驗(yàn)方案中規(guī)定的、對(duì)安全性評(píng)價(jià)重要的不良事件和實(shí)驗(yàn)室異常值,應(yīng)當(dāng)按照試驗(yàn)方案的要求和時(shí)限向申辦者報(bào)告。
涉及死亡事件的報(bào)告,研究者應(yīng)當(dāng)向申辦者和倫理委員會(huì)提供其他所需要的資料,如尸檢報(bào)告和最終醫(yī)學(xué)報(bào)告。
研究者收到申辦者提供的臨床試驗(yàn)的相關(guān)安全性信息后應(yīng)當(dāng)及時(shí)簽收閱讀,并考慮受試者的治療,是否進(jìn)行相應(yīng)調(diào)整,必要時(shí)盡早與受試者溝通,并應(yīng)當(dāng)向倫理委員會(huì)報(bào)告由申辦方提供的可疑且非預(yù)期嚴(yán)重不良反應(yīng)。
這里足足有334個(gè)字符來講解安全性報(bào)告,報(bào)告的對(duì)象也就只有申辦者一方,形式上也沒有過多限制,而且內(nèi)容也越來越與ICH-GCP中的內(nèi)容貼合,這里與ICH-GCP的高度契合也更體現(xiàn)了中國政府對(duì)新藥研發(fā)的國際化態(tài)度與決心。
另外新版GCP特別強(qiáng)調(diào)了關(guān)于研究者應(yīng)當(dāng)在簽收閱讀后應(yīng)當(dāng)考慮受試者的治療是否需要調(diào)整。這里更多的是體現(xiàn)了法規(guī)更多的保護(hù)受試者的安全及權(quán)益。
總之,2020版GCP相較于2003版GCP來說,不管是對(duì)受試者來說,還是對(duì)協(xié)助研究者上報(bào)安全性報(bào)告的CRC來說,都是大大利好呀!
作者:維多利亞

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

大多數(shù)剛畢業(yè)的同學(xué)在準(zhǔn)備進(jìn)入臨研圈的時(shí)候,一定會(huì)被鋪天蓋地的行業(yè)專有名詞搞得暈頭轉(zhuǎn)向。什么CRA/CTA/CRC/CRO,都是什么鬼?CEO和COO我倒是知道,請(qǐng)問貴司CEO接受應(yīng)屆生嗎?

何所謂溝通?溝者,構(gòu)筑管道也;通者,順暢也。溝通是人與人之間以及人與群體之間思想與感情的傳遞和反饋的過程,以求思想達(dá)成一致和感情的通暢。溝通的目的是讓對(duì)方達(dá)成行動(dòng)

病例報(bào)告表(CRF)是臨床試驗(yàn)中記錄臨床資料的表格,每一受試者有關(guān)試驗(yàn)的資料均應(yīng)記錄在預(yù)先按試驗(yàn)方案設(shè)計(jì)的病例報(bào)告表中。它們依據(jù)原始記錄而填寫,以便申辦者對(duì)不同試驗(yàn)單

臨床研究協(xié)調(diào)員(全稱Clinical Research Coordinator,簡稱CRC):指經(jīng)主要研究者授權(quán),在臨床試驗(yàn)中協(xié)助研究者進(jìn)行非醫(yī)學(xué)性的相關(guān)事務(wù)性工作,是臨床試驗(yàn)的參與者。 臨床試驗(yàn)現(xiàn)場管理組

生物樣品分析在臨床試驗(yàn)中起著非常重要的作用,是臨床試驗(yàn)研究中一個(gè)關(guān)鍵的環(huán)節(jié),在臨床試驗(yàn)過程中,CRC很多時(shí)候也會(huì)被授權(quán)參與生物樣本的管理,因此我們小伙伴們也要掌握這項(xiàng)

回顧以往的文章,自己還真的沒有寫關(guān)于CRC管理方面的心得,今天就六個(gè)方面淺談一下個(gè)人的心得體會(huì)。
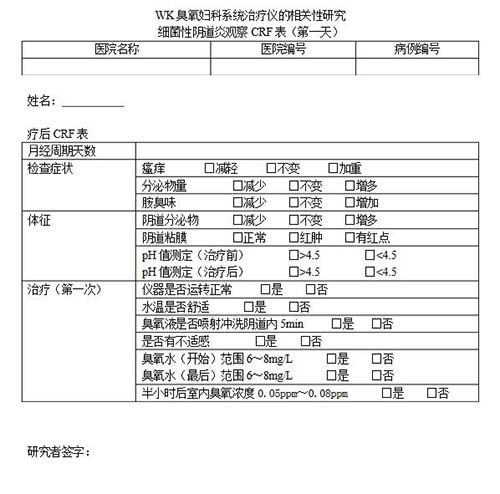
病例報(bào)告表(case report form,CRF)是按照臨床試驗(yàn)方案的要求設(shè)計(jì)的書面文件,用于記錄和報(bào)告每一名受試者在試驗(yàn)過程中的數(shù)據(jù),這種文件一般采用表格(紙質(zhì)或電子)的形式。"

隨著越來越多的臨床試驗(yàn)中都配備 CRA,CRA 與 CRC 在臨床試驗(yàn)中的作用及合作值得大家一起探討。首先,介紹一下在項(xiàng)目運(yùn)行中可能出現(xiàn)的問題和矛盾,間接影響了項(xiàng)目的執(zhí)行和質(zhì)量。希

GCP證書會(huì)過期嗎?針對(duì)這個(gè)問題,特地查詢了目前我國所有的臨床現(xiàn)行法律法規(guī),都沒有發(fā)現(xiàn)GCP證書有效期的規(guī)定。對(duì)于GCP證書的更新問題,業(yè)內(nèi)有傳言五年一延續(xù)的說法,下面一起來

病例報(bào)告表 (CRF填寫指南) (第1版) 一、制定本指南目的: 為加強(qiáng)對(duì)醫(yī)療器械臨床研究的監(jiān)督管理,保證臨床病歷報(bào)告表記錄真實(shí)、規(guī)范、完整,提高臨床試驗(yàn)的質(zhì)量,根據(jù)《醫(yī)療
行業(yè)資訊
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
